
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4 L CH2Cl2中含有的CH2Cl2分子数为NA
B. 60 g SiO2中含Si-O键数目为2NA
C. 足量浓硫酸与65 g锌发生反应,转移的电子数为2NA
D. pH=1的H2SO4溶液中含有的H+ 数目为0.1NA
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 苯和甲烷均不能发生氧化反应
B. 甲烷和Cl2的反应与乙烯和Br2的反应,属于同一类型的反应
C. 水煤气可用来合成液态烃及甲醇等含氧有机物
D. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4,7—二甲基香豆素(熔点:132.6℃)是一种重要的香料。由间甲苯酚为原料合成4,7—二甲基香豆素的反应如下:
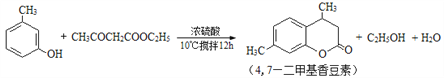
实验装置图如下:
主要实验步骤:
步骤1:向装置a中加入60 mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30 mL(0.29 mol)和乙酰乙酸乙酯26.4 mL(0.21 mol)的混合物。
步骤2:保持10℃,搅拌12 h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗产品。
步骤3:粗产品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0 g。
(1)简述装置b中将活塞上下部分连通的目的_____________。
(2)装置c的名称为_____________,与过滤相比,抽滤的优点是_____________。
(3)浓硫酸需要冷却至0℃以下的原因是_____________。
(4)反应需要搅拌12 h,其原因是_____________。
(5)本次实验产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
A.相同浓度溶液的碱性:Na2CO3>NaHCO3
B.在水中的溶解度:Na2CO3>NaHCO3
C.与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3
D.热稳定性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 锌粉加入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B. 氯化铁溶液腐蚀铜线路板:2Fe3++3Cu=2Fe+3Cu2+
C. 氢氧化铝加入醋酸溶液中:Al(OH)3+3H+=Al3++3H2O
D. 氯化钡溶液滴入硫酸氢钠溶液中:Ba2++SO42-=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=a的NaOH溶液与pH=b的醋酸溶液等体积混合后,两者恰好完全反应,则该温度下醋酸的电离平衡常数约为
A. 1014-a-2b B. 10 a+b-14 C. 10a-2b D. 10a-2b+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.1%),还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
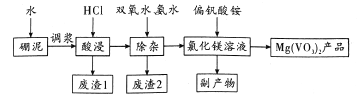
回答下列问题:
(l)Mg(VO3)2 中V的化合价为_____,副产物的电子式为_______。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为______。写出”酸浸”后溶液中存在的金属阳离子_______,废渣1可用于制作_______,该物质在信息传输中具有重要应用。
(3)“除杂”过程加人双氧水的目的是_______(用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于l×10-6mol·L-1,在室温下需调节pH范围为__________[已知Ksp[Fe(OH)3]= 1×10-39, Ksp[Al(OH)]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:__________。
(5)偏钒酸氨可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_________。
(6)现用a t硼泥生产Mg(VO3)2,若生产过程的产率为6%,则能生产出Mg(VO3)2产品的
质量为_________t (用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z、W、R、T六种短周期主族元素,它们的原子序数依次增大, W与R同主族,且W的氢化物常温时为液态。X、Y的最外层电子数之和与Z的最外层电子数相等,X分别与Y、Z、W形成电子总数相等的分子。
请用化学用语回答下列问题:
(1)Y、Z、W元素的氢化物沸点由高到低的顺序为____________(用化学式表示)。
(2)选取上述六种元素中的某些元素组成的化合物中,写出既含极性键又含非极性键,且相对分子质量最小的物质______________(写电子式)。该物质与空气在酸性条件下可构成燃料电池,该电池放电时,负极的反应式为_______________________________。
(3)请用一个化学方程式证明W元素的非金属性强于R元素_________________________________。
(4)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的Z4气态分子。Z4分子结构如图所示,己知断裂lmolZ-Z 吸收167kJ的热量,生成lmol Z![]() Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。
Z放出942kJ热量。试写出Z4气态分子变成Z2气态分子的热化学方程式:_________________________________。

(5)①由X、Z、W三种元素形成的一种离子化合物,其水溶液中离子浓度由大到小的顺序是________________________。
②写出检验该化合物中阳离子的实验操作方法是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com