
下列各变化中属于原电池的反应的是( )
|
| A. | 在空气中金属铝表面迅速氧化形成保护层 |
|
| B. | 从海水中通过化学方法得到金属镁 |
|
| C. | 红热的铁丝与冷水接触,表面表成蓝黑色保护层 |
|
| D. | 锌和稀硫酸反应时,加入少量的CuSO4溶液可使反应加快 |
考点:
原电池和电解池的工作原理.
专题:
电化学专题.
分析:
属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答:
解:A.铝是亲氧元素,在空气中,铝极易和氧气反应生成氧化物薄膜,该反应中没有两个活泼性不同的电极,不能构成原电池,所以发生的不是原电池反应,故A错误;
B.工业用电解的方法冶炼镁,与原电池无关,故B错误;
C.红热的铁丝和水直接反应生成黑色的四氧化三铁和氢气,不符合原电池构成条件,属于化学腐蚀,故C错误;
D.锌置换出铜,Zn、Cu、稀硫酸构成原电池,进而加快反应速率,与电化学有关,故D正确.
故选D.
点评:
本题考查了化学腐蚀和电化学腐蚀的判断,为高频考点,侧重于学生的分析能力的考查,根据原电池构成条件来分析解答即可,难度不大.


科目:高中化学 来源: 题型:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 ﹣﹣
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,反应的离子方程式为 .
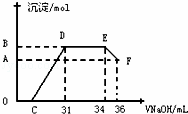
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为: .
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为 .
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)⇌2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
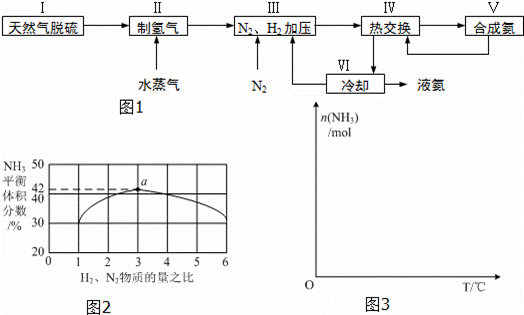
完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生.NH4HS的电子式是 ,写出再生反应的化学方程式: .NH3的沸点高于H2S,是因为NH3分子之间存在着一种比 更强的作用力.
(2)室温下,0.1mol/L的氯化铵溶液和0.1mol/L的硫酸氢铵溶液,酸性更强的是 .已知:H2SO4:Ki2=1.2×10﹣2NH3•H2O:Ki=1.8×10﹣5.
(3)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系.根据图中a点数据计算N2的平衡体积分数: (答案用小数表示,保留3位有效数字).
(4)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图.
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号) .简述本流程中提高合成氨原料总转化率的方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
|
| A. | H2O(g)=H2(g)+ |
|
| B. | 2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 |
|
| C. | H2(g)+ |
|
| D. | 2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
|
| A. | 未通电前上述镀锌装置可构成原电池,锌为负极,电镀时锌与电源负极相连为阴极 |
|
| B. | 电镀时通过1mol电子,阴极上有0.5mol锌的析出 |
|
| C. | 未通电前K+向铁极移动,通电后K+还向铁极移动 |
|
| D. | 镀锌层破损后对铁制品失去保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于“摩尔”的理解正确的是( )
-A.-摩尔是国际科学界建议采用的一种物理量
-B.-摩尔是物质的量的单位,简称摩,符号为mol
-C.-摩尔可以把物质的宏观数量与微观粒子的数量联系起来
-D.-国际上规定,0.012kg碳原子所含有的碳原子数目为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若某药品质量约为32g 托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
50g0g0g0g-5g
----
如图所示,配制500mL 1.5mol/L Na2CO3溶液,所需Na2CO3的质量为 g,
实验操作的先后顺序为 (填编号).
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响.
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度 .
②配制450mL 0.1mol•L﹣1的NaOH溶液,用托盘天平称取NaOH固体1.8g .
③配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 .
④定容时仰视刻度线 .
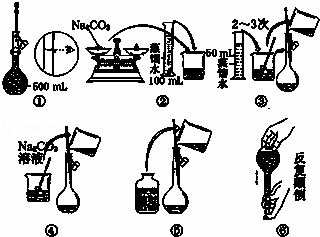
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L氦气 ③4℃9mL水 ④0.2mol H3PO4.
|
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com