
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
分析 A、常温下,铁在浓硝酸中会钝化;
B、溶液体积不明确;
C、蔗糖溶液中,除了蔗糖分子还有水分子;
D、乙酸和甲醛的最简式均为CH2O.
解答 解:A、常温下,铁在浓硝酸中会钝化,故不能反应完全,故转移的电子数小于0.3NA个,故A错误;
B、溶液体积不明确,故溶液中的S2-和HS-的个数无法计算,故B错误;
C、蔗糖溶液中,除了蔗糖分子还有水分子,故溶液中的分子个数多于0.6NA个,故C错误;
D、乙酸和甲醛的最简式均为CH2O,故30g混合物中含有的CH2O的物质的量为1mol,则含有NA个氧原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | AsH3>NH3>PH3 | B. | PH3>AsH3>NH3 | C. | NH3>PH3>AsH3 | D. | NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
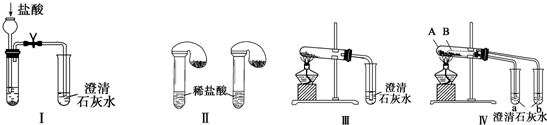
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
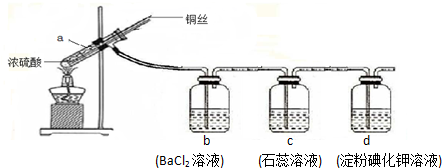
| A. | a装置中有白色固体 | B. | b装置中产生白色沉淀 | ||
| C. | c装置中溶液先变红后褪色 | D. | d装置中溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 定量分析--测沸点 | |
| B. | 定性分析--滴入酸性高锰酸钾溶液 | |
| C. | 定量分析--使用银氨溶液 | |
| D. | 定性分析--与新制氢氧化铜悬浊液共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
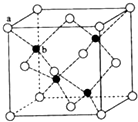 E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素,E、G、M是位于P区的同一周期的元素,M的价层电子排布为Nsnnp2n,E与M原子核外的未成对电子数相等;QM2与GM2-为等电子体;T为过渡元素,其原子核外没有未成对电子.请回答下列问题: .E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
.E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4、N2、CO2均属于非电解质 | B. | NO2、CO2、H2O均属于氧化物 | ||
| C. | CH4、NO2、CO2均属于非极性分子 | D. | 该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
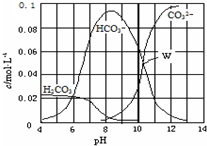
| A. | W点所示的溶液:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | pH=4的溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO3-)+c(H2CO3) | |
| D. | pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 弱碱的浓度大于强酸的浓度 | |
| B. | 原氨水中有1%的含氮微粒为NH4+ | |
| C. | 反应后的溶液呈酸性 | |
| D. | 混合溶液中c(NH4+)+c(NH3•H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com