
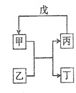
 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
分析 根据反应甲+乙→丙+丁,丙+戊→甲分析,将四个选项中的各物质代入,结合物质的性质判断这两个反应是否能发生,如果能发生,则正确,否则错误.
解答 解:①4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O,一氧化氮和水不反应,所以不能实现转化,故错误;
②3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,3H2+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O,所以能实现转化,故正确;
③Al2O3+2NaOH=2NaAlO2+H2O,NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 ,所以不能实现转化,故错误;
④2Na2O2+2CO2=2Na2CO3+O2,2 Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,所以能实现转化,故正确;
故选A.
点评 本题考查物质之间的化学反应,明确物质的性质是解本题关键,注意铁和水蒸气反应生成四氧化三铁而不是氧化铁,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | Al3+、Cu2+、SO42-、Cl- | D. | Na+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
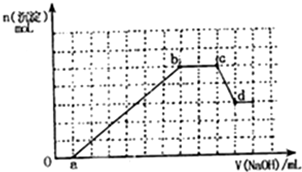 某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.
某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al 1s22s22p63s23p1 | B. | O2- 1s22s22p4 | ||
| C. | Na 1s22s22p63s1 | D. | F 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃烧一定要用火去点燃 | |
| B. | 对“地沟油”进行分馏可得到汽油 | |
| C. | 2013年诺贝尔化学奖授予三位美国化学家,以表彰他们设计出多尺度复杂化学系统模型,将传统化学实验搬到了网络世界.这一完美结合现实与理论的化学系统模型,为更全面了解并预测化学反应进程奠定了基础 | |
| D. | 化肥的使用有效地提高了农作物的产量,常见的氮肥可分为铵态氮肥和硝态氮肥,硝酸盐和尿素都属于硝态氮肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| PH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | pH=7.30的血液中,HCO3-的水解程度一定大于H2CO3的电离程度 | |
| B. | 人体血液酸中毒时,可注射NaHCO3溶液缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)<c(HCO3-) | |
| D. | 正常人体血液中,HCO3-的水解程度大于它的电离程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com