
下列过程中△H小于零的是()
A. 碳酸氢钠受热分解 B. 氯化铵分解得氨气
C. 碳酸钙分解得二氧化碳 D. 实验室制备氢气
考点: 反应热和焓变.
专题: 化学反应中的能量变化.
分析: △H小于零,应是放热过程,常见有化合反应,金属与酸、水的反应,以及中和反应等,物质三态变化时,从气态到液态,从液态到固态,也是放热过程;弱酸的电离过程属于吸热过程,以此解答该题.
解答: 解:A、碳酸氢钠受热分解是吸热反应,△H>0,故A错误;
B.氯化铵分解为吸热反应,△H>0,故B错误;
C.碳酸钙分解是吸热反应,△H>0,故C错误;
D.实验室制备氢气用活泼金属与酸反应,为放热反应,△H<0,故D正确;
故选D.
点评: 本题考查反应热与焓变,题目难度不大,注意常见吸热反应和放热反应即可解答该题,学习中注意相关基础知识的积累.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
取1.43g Na2CO3•10H2O溶于水配成100mL溶液,求:
(1)Na2CO3溶液的物质的量浓度
(2)Na+物质的量浓度
(3)取出20ml该溶液用水稀释,使Na2CO3溶液的物质的量浓度变为0.004mol/L,求加入水的体积(设稀释时,对溶液体积的影响忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细.由此判断下表中所列M、N、P物质,其中可以成立的是()
M N P
A 锌 铜 稀硫酸溶液
B 铜 铁 稀盐酸
C 银 锌 硝酸银溶液
D 锌 铁 硝酸铁溶液
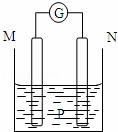
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
已知NaHC2O4溶液显弱酸性,向100mL0.1mol•L﹣1的NaHC2O4.溶液中分别加入下列物质,有关说法正确的是()
A. 加入少量H2 C2O4固体,促进水电离,溶液中c(H+)增大
B. 加入NaOH溶液至恰好完全反应,则溶液中:c(Na+)>c(C2O42﹣)>c(HC2O4﹣)>c(H+)
C. 加入氨水至中性,则溶液中:c(NH4+)+c(Na+)=2c(C2O42﹣)+c(HC2O4﹣)
D. 加入0.01 mol Na2C2O4固体,则溶液中:3c(Na+)=2
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列化学反应的热现象,不正确的说法是()
A. 有些放热反应发生时需要加热
B. 化学反应一定既有物质变化又有能量变化
C. 吸热反应都需要加热后才能发生
D. 化学反应热效应数值与反应物质多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个容积为2L的密闭容器中,发生如下反应:3X(气)+Y(气)═2Z(气),若最初加入的X、Y和Z都是1mol,反应中X的平均反应速率为0.12mol•L﹣1•s﹣1.若要产物Z为1.8mol,反应所需的时间为()
A. 5s B. 10s C. 15s D. 20s
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的△H前者 大于后者的是()
大于后者的是()
①C(s)+O2(g)═CO2(g);△H1 C(s)+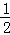 O2(g)═CO(g);△H2
O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+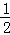 O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
A. ① B. ④ C. ②③④ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l)△H=﹣Q1 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(l)△H=﹣Q2 kJ/mol
2H2S(g)+O2(g)=2S(s)+2H2O(g)△H=﹣Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是()
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,科学家正在研究开发一种高能电池﹣﹣钠硫电池,它以熔融钠、硫为两极,以导电的β﹣A2lO3陶瓷作固体电解质,反应式如下:Na2SX 2Na+xS以下说法正确的是()
2Na+xS以下说法正确的是()
A. 放电时,Na作正极,S极发生还原反应
B. 放电时,Na发生还原反应
C. 充电时,钠 极与外电源的正极相连
极与外电源的正极相连
D. 充电时,阳极发生的反应为:SX2﹣﹣2e=xS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com