
| A.通过煤的直接或间接液化可以获得各种芳香烃 |
| B.通过石油的催化重整等工艺可获取芳香烃 |
| C.石油的裂化的目的主要是为了提高轻质油的产量 |
| D.石油的裂解的目的主要是为了获取不饱和烯烃 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:填空题
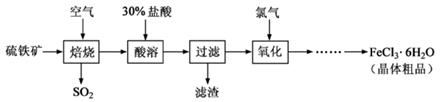
 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
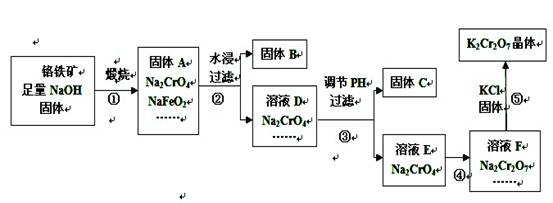
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯碱工业中阳极得到氢氧化钠和氢气 |
| B.电镀铜时,电镀液中c(Cu2+)基本保持不变 |
| C.合成氨中采取及时分离液态氨来提高反应速率 |
| D.海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
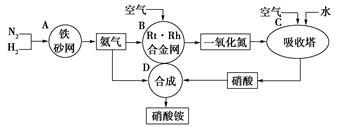
 (1)吸收塔C中通人空气的目的是
(1)吸收塔C中通人空气的目的是  2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
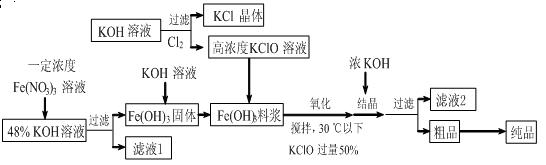
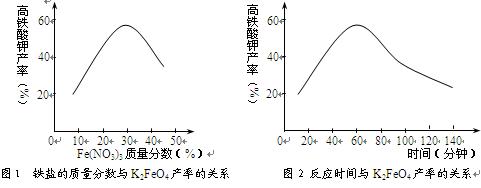
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com