
| A. | 亚硫酸钠有还原性,可用作脱氧剂 | B. | FeCl3有氧化性,可用于制印刷电路 | ||
| C. | 铝有还原性,可冶炼某些金属 | D. | 浓硫酸有吸水性,可用于干燥氨气 |
分析 A.亚硫酸钠中硫元素化合价易升高,能够提供电子;
B.氯化铁具有氧化性,能够氧化铜;
C.铝具有强还原性,高温下,能还原某些金属氧化物;
D.浓硫酸具有酸性,不能干燥碱性气体.
解答 解:A.亚硫酸钠中硫元素化合价易升高,能够提供电子,具有还原性,能够做脱氧剂,故A正确;
B.氯化铁具有氧化性,与铜反应生成氯化亚铁和氯化铜,能够制造印刷电路板,故B正确;
C.铝具有强还原性,高温下,能还原某些金属氧化物,所以可以通过铝热反应冶炼某些高熔点金属,故C正确;
D.氨气为碱性气体,与浓硫酸反应生成硫酸铵,不能用浓硫酸干燥,故D错误;
故选:D.
点评 本题为综合题考查了元素化合物知识,熟悉亚硫酸根、氯化铁、铝、浓硫酸的性质是解题关键,注意浓硫酸具有酸性、脱水性、吸水性、强的氧化性,不能够干燥碱性、还原性气体,题目难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
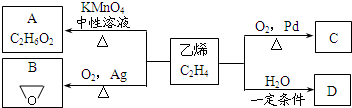 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.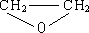 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
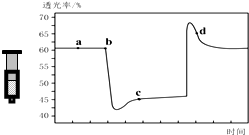 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
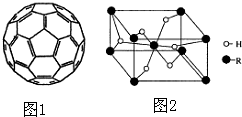
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
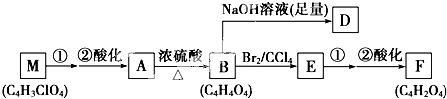
 +(2n-1)H2O.
+(2n-1)H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定低于M的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com