
| A. | X>Y>Z | B. | Z>Y>X | C. | Y>Z>X | D. | Y>X>Z |
科目:高中化学 来源: 题型:选择题
| A. | 4:1 | B. | 3:2 | C. | 5:3 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
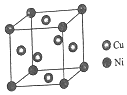 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和Li同一主族的都是金属元素 | B. | Na+比Li多一个电子层 | ||
| C. | Li、Na、K+的最外层都只有一个电子 | D. | Li是碱金属中原子半径最小的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M | N | ||
| X | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+C12$\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2=CH2+H2O→CH3-CH2OH | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$  +HBr +HBr | |
| D. | 2 CH3CH2OH+O2$→_{△}^{Cu}$ 2 CH3CHO+2 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com