
【题目】将一定质量的镁铝合金投入100 mL一定物质的量浓度的盐酸中,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示。

(1)当沉淀达到最大值时,Al(OH)3的质量;
(2)原合金中Mg的质量;
(3)盐酸的物质的量浓度。
【答案】(1)3.9(g)(2分)(2)2.4g(2分) (3)4mol/L (2分)
【解析】
试题0~10段发生H++OH-=H2O;
10~80段发生Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓;
80~90段发生Al(OH)3+OH-=AlO2-+2H2O;
(1)沉淀达到最大时,此时Mg、Al 元素转化成Mg(OH)2、Al(OH)3,5.8g沉淀是Mg(OH)2,因此Al(OH)3的质量为(9.7-5.8)g=3.9g;(2)根据镁元素守恒n(Mg)=n[Mg(OH)2]=5.8/58mol=0.1mol,则m(Mg)=0.1×24g=2.4g;(3)当沉淀达到最大,溶液中溶质为NaCl,因此有n(NaOH)=n(NaCl)=n(HCl)=80×10-3×5=100×10-3×c(HCl),解得c(HCl)=4mol·L-1。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】由下列实验及现象能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向有少量铜粉的Cu(NO3)2 溶液中滴入稀硫酸 | 铜粉逐渐溶解 | 稀硫酸能与铜单质反应 |
B | 向H2O2溶液中滴入少量酸性高锰酸钾溶液 | 立刻产生大量气体 | KMnO4是H2O2分解的催化剂 |
C | 向盛有浓氨水的锥形瓶中通入氧气,并将灼热的铂丝置于液面上方 | 铂丝保持红热,且瓶内有白烟产生 | 氨的催化氧化反应为放热反应 |
D | 将金属钠放入燃烧匙中,点燃, 迅速伸入集满SO2的集气瓶 | 产生大量黄色的烟,且瓶 内有白色颗粒生成 | SO2具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下取金属钠、铝、铁各1克,加入1mol/L的硫酸V升,要使铝、铁反应后放出等量的氢气,且比钠反应生成的氢气少,V的大小范围是( )
A. V≥![]() B. V≤
B. V≤![]() C. V<
C. V<![]() D. V≤
D. V≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁黄是一种重要的颜料,化学式为Fe2O3xH2O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含Fe2O3及少量的CaO、MgO等)和黄铁矿粉(主要成分为FeS2)制备铁黄的流程如图:

(1)操作Ⅰ与操作Ⅱ中都用到玻璃棒,玻璃棒在两种操作中的作用分别是________、________。
(2)试剂a最好选用______(供选择使用的有:铝粉、空气、浓HNO3);其作用是________。
(3)上述步骤中需用到氨气.下列装置可用于实验室制氨气的是______(填序号)。

(4)检验溶液Z中含有NH4+的方法是________。
(5)查阅资料知,在不同温度下Fe2O3被CO还原,产物可能为Fe3O4、FeO或Fe,固体质量与反应温度的关系如下图所示。

根据图像推断650℃时Fe2O3还原产物的化学式为________,并设计一个简单的实验,证明该还原产物的成分(简述实验操作、现象和结论)________。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2O2溶液、NaOH溶液、KSCN溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl﹣浓度最小的是( )
A.200mL 2mol/L MgCl2溶液B.1000mL 2.5mol/L NaCl溶液
C.300mL 5mol/L KCl溶液D.250mL 1mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

(1)在右图装置中,观察到装置甲铜电极上产生大量的无色气体; 而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是__________________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____________________________________。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr (Ⅲ) 常见的处理方法是电解法和铁氧磁体法。
①电解法: 将含Cr2O72- 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl 进行电解,使阳极生成的Fe2+和Cr2O72- 发生反应,其离子方程式为_______________。阴极上Cr2O72- 、H+、Fe3+都可能放电。若Cr2O72- 放电,则阴极的电极反应式为_________; 若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀,已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。
②铁氧磁体法: 在含Cr (Ⅵ) 的废水中加入绿矾,在pH<4时发生反应使Cr (Ⅵ) 转化为Cr (Ⅲ),调节溶液pH 为6~8,使溶液中的Fe (Ⅱ)、F e(Ⅲ)、Cr (Ⅲ)析出组成相当于Fe(Ⅱ) [Fe(Ⅲ)x·Cr (Ⅲ)2-x] O4(铁氧磁体) 的沉淀,则铁氧磁体中x=_________; 若废水中Cr (Ⅵ) 以CrO3计,用该法除去废水中的Cr (Ⅵ),加入的FeSO4·7H2O 与CrO3的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿克拉酮是合成某种抗癌药的重要中间体,其结构如图所示。下列关于阿克拉酮的性质的描述,正确的是

A. 阿克拉酮的分子式为C22H23O8
B. 分子中含有5个手性碳原子
C. 该分子一定条件下能发生取代、氧化、消去反应
D. 1 mol该物质与 NaOH溶液反应,最多可反应3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确认HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此完成下列问题:
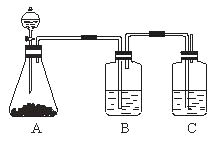
(1)锥形瓶中装某可溶性正盐溶液,分液漏斗所盛试剂应为______。
(2)装置B所盛试剂是______,其作用是___________。
(3)装置C所盛试剂是______,C中反应的离子方程式是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com