
| 实验序号 | 实验内容 | 实验结果 |
| ① | 第一份中加AgNO3溶液 | 有白色沉淀生成 |
| ② | 第二份中加足量NaOH溶液并加热 | 只收集到标准状况下0.896L气体,无沉淀生成,同时得到溶液A |
| ③ | 向溶液A中通入过量CO2,所得白色沉淀经过滤、洗涤、灼烧后称量 | 固体质量为2.04g |
| ④ | 第三份加足量BaCl2溶液,所得沉淀经足量稀盐酸洗涤、干燥后称量 | 沉淀质量为23.3g |
| 阴离子符号 | 物质的量浓度(mol?L-1) |
| 0.896L |
| 22.4L/mol |
| 2.04g |
| 102g/mol |
| 23.3g |
| 233g/mol |
| 0.896L |
| 22.4L/mol |
| 2.04g |
| 102g/mol |
| 23.3g |
| 233g/mol |
| 23.3g |
| 233g/mol |
| 0.1mol |
| 0.1L |


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
| A、0.15 mol NO2与水完全反应时转移的电子数为0.1 NA |
| B、标准状况下,224 mL水含有的电子数为0.1 NA |
| C、常温常压下,0.56 L甲烷中含有的共价键数为0.1NA |
| D、25℃,pH=l的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000mL,212g |
| B、950mL,543.4g |
| C、任意规格,572g |
| D、500mL,286g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在NaAlO2溶液中加入过量盐酸溶液 |
| B、在AlCl3溶液中加入过量氨水 |
| C、在AlCl3溶液中加入过量NaOH溶液 |
| D、用Al2O3与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

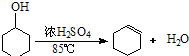
| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
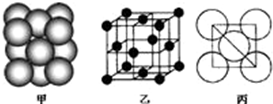 ①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置
①若某金属M为第四周期单电子数最多的元素,该元素在周期表中的位置查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第二周期ⅣA族 |
| B、第二周期ⅥA族 |
| C、第三周期ⅡA族 |
| D、第三周期ⅣA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com