
| A. | 标准状况下,Cl2的摩尔质量为71g | |
| B. | 氧化还原反应一定有氧元素参加 | |
| C. | 国际上规定,0.012kg 12C所含有的碳原子数约为1mol | |
| D. | Na2CO3属于钠盐,又属于碳酸盐是用交叉分类法分类的 |
分析 A、摩尔质量的单位是g/mol;
B、氧化还原反应是指有元素的化合价升降的反应;
C、阿伏伽德罗常数的单位为mol-1,根据微粒数目和物质的量的单位来判断;
D、交叉分类法是对同一化学物质或化学反应采用不同的“标准”进行分类.
解答 解:A、标准状况下,Cl2的摩尔质量为71g/mol,故A错误;
B、氧化还原反应是指有元素的化合价升降的反应,不一定有氧元素参加,故B错误;
C、阿伏伽德罗常数的单位为mol-1,而0.012kg12C的物质的量为1mol,其中所含碳原子数与阿伏伽德罗常数在数值上相等,即0.012kg12C中所含碳原子数为阿伏伽德罗常数,故C错误;
D、Na2CO3从组成的阳离子来看,其属于钠盐,而从组成的阴离子来看,其又属于碳酸盐,可以看到,从不同的角度分类,Na2CO3属于不同的类别,出现了交叉现象,因此分类方法属于交叉分类法,故D正确.
故选D.
点评 本题考查了物质的分类方法、氧化还原反应的判断、阿伏伽德罗常数的意义等知识,注意知识的归纳和梳理是关键,难度不大.


科目:高中化学 来源: 题型:解答题
 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: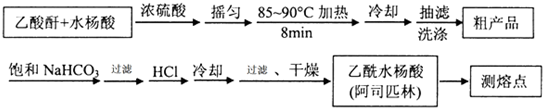
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大、c(HF)减小,则$\frac{c({H}^{+})c({F}^{-})}{c(HF)}$增大 | |
| C. | 稀释过程中,c(OH-)、$\frac{c({H}^{+})}{c(HF)}$均增大 | |
| D. | 溶液的KW、$\frac{c({F}^{-})}{c({H}^{+})}$、pH均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/kPa | 2 | 5 | 10 | 12 |
| C(D)/mol•L- | 0.08 | 0.20 | 0.40 | 0.48 |
| A. | 当压强增大时平衡向左移动 | B. | m+n>q | ||
| C. | 增加压强,平衡常数增大 | D. | 平衡不随着压强的变化移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述三个转化中只有一个涉及氧化还原反应 | |
| B. | 第二步离子方程式为:Cr2O72-+14H++6Fe2+=2Cr3++7H2O+6Fe3+ | |
| C. | 处理含铬废水可使用强碱Ba(OH)2,也可以使用弱碱氨水 | |
| D. | 当pH≥5时,废水中铬元素沉淀完全 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛的结构简式为CH3COH | B. | 乙烷的结构简式为:CH3CH3 | ||
| C. | 羟基的电子式为[:O:H]- | D. | 氯离子的结构示意图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片为负极 | B. | 铁片上发生还原反应 | ||
| C. | 电流由铁片沿导线流向铜极 | D. | 铜片上的电极方程式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )
为保证比赛成绩的公正、公平,反兴奋剂是一项重要而艰巨的工作.某种兴奋剂的结构简式如图所示.有关该物质的说法错误的是( )| A. | 该有机物能与FeCl3溶液发生显色反应 | |
| B. | 一定条件下1mol该物质能与7molH2发生加成反应 | |
| C. | 该有机物分子中所有的原子不可能在同一平面 | |
| D. | 该有机物是苯酚的同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com