
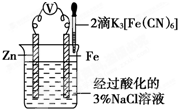
 为探究铁腐蚀的保护方法,某同学按图连接好装 置并往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液.
为探究铁腐蚀的保护方法,某同学按图连接好装 置并往Fe电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=4 | B、a=b |
| C、b<a | D、m等于2或1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2+ Na+ NO3- Cl- |
| B、Ba2+ Na+ NO3- Cl- |
| C、SO42- SO32- NH4+ Na+ |
| D、Mg2+ Na+ Br- ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H<0,△S>0 |
| B、△H>0,△S>0 |
| C、△H<0,△S<0 |
| D、△H>0,△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
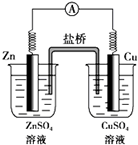
| A、反应中,盐桥中的Cl-会移向ZnSO4溶液 |
| B、取出盐桥后,电流计依然发生偏转 |
| C、铜片上有气泡逸出 |
| D、锌为负极,发生还原反应,电极反应式为:Zn-2e-=Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2分子的结构式:O=C=O | ||
B、O-18的原子符号:
| ||
C、S2-离子的结构示意图: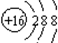 | ||
D、氯化氢分子的电子式: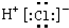 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com