
| A. | 1种 | B. | 2种 | C. | 3 种 | D. | 4种 |
分析 乙酸与乙醇的酯化反应中:乙酸中的羧基提供羟基、乙醇中的羟基提供氢原子,羟基和氢原子形成水,剩下基团结合的形成酯,据此进行判断.
解答 解:若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应的化学方程式为:CH3C18O18OH+H16OCH2CH3$?_{△}^{浓硫酸}$CH3C18O16OCH2CH3+H218O,
根据反应可知,酯化反应是可逆反应,所以含有18O的物质有:CH3C18O18OH、CH3C18O16OCH2CH3、H218O三种物质,
故选C
点评 本题考查了酯化反应原理,题目难度不大,明确酯化反应原理“酸脱羟基醇脱氢”含义为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
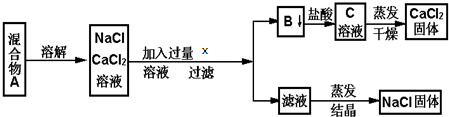
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,反应类型加聚反应
,反应类型加聚反应查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.漂白粉露置在空气中:ClO-+CO2+H2O=HClO+HCO3-
B.用过量氨水吸收二氧化硫:SO2+NH3·H2O=HSO3-+NH4+
C.少量CO2通入苯酚钠溶液:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
D.磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com