
有下列两组命题
B组命题正确且能用A组命题加以正确解释的是
科目:高中化学 来源: 题型:填空题
某淡黄色的颗粒状固体,其化学性质比较活泼,在通常状况下能跟许多物质发生化学反应。例如:它与CO2反应时,只生成了Na2CO3和O2,它与稀盐酸反应时,只生成了NaCl、H2O和O2。上课时,老师做了如下实验:
a.取少量的淡黄色的颗粒状固体投入到盛有少量水的试管中,可观察到产生了一种无色无味的气体;
b.再向试管中滴加几滴酚酞试液,可观察到烧杯中溶液变红。
根据实验现象,回答下列问题:
(1)淡黄色的颗粒状固体中一定含有________元素。你做出这个判断的理由是________。
(2)实验a中产生的气体,可用________法收集。
(3)同学们对实验a中产生的气体的组成看法不一,提出了以下几种假设:
①该气体是CO; ②该气体是H2。
请你推测该气体还可能是________(写化学式)。
(4)设计一个实验,证明你在(3)中的推测(写出简要操作步骤,反应现象和结论)。
操作步骤:________
反应现象:________
结论:________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下,向某Ba(OH)2溶液中逐滴加入pH=x的盐酸,测得如下数据:
| 序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 22.00 | 0.00 | 12 |
| ② | 22.00 | 18.00 | 11 |
| ③ | 22.00 | 22.00 | 7 |
x=________ ;Ba(OH)2溶液的物质的量浓度为________________
(2)常温下,向100mL pH=2的硫酸与硫酸钠的混合溶液中,加入300mL上述Ba(OH)2溶液,沉淀正好达最大量,此时溶液的pH________7(填“>”“<” 或“=”);原混合溶液中硫酸钠的物质的量浓度为________
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
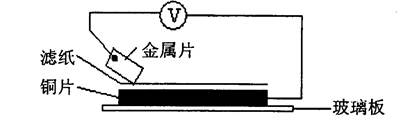

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com