
| A. | 由非电解质溶于水得到的溶液 | |
| B. | c(H+)、c(OH-)均为5.0×10-7mol•L-1的溶液 | |
| C. | 等物质的量的强酸与强碱反应得到的溶液 | |
| D. | 将pH=9的烧碱溶液稀释100倍所得到的溶液 |
分析 A.由非电解质溶于水得到的溶液可能呈酸性、碱性或中性;
B.任何水溶液中只要c(H+)=c(OH-),则该溶液就一定呈中性;
C.等物质的量的强酸与强碱反应得到的溶液可能呈酸性、碱性或中性;
D.碱无论如何稀释都不能得到酸性或中性溶液.
解答 解:A.由非电解质溶于水得到的溶液可能呈酸性、碱性或中性,如二氧化硫、三氧化硫溶液呈酸性,氨气水溶液呈碱性,乙醇溶液呈中性,故A错误;
B.该溶液中存在c(H+)=c(OH-),则该溶液就一定呈中性,故B正确;
C.等物质的量的强酸与强碱反应得到的溶液可能呈酸性、碱性或中性,如硫酸和NaOH的混合溶液呈酸性、稀盐酸和氢氧化钠溶液呈中性、盐酸和氢氧化钡溶液呈碱性,故C错误;
D.碱无论如何稀释都不能得到酸性或中性溶液,所以将pH=9的烧碱溶液稀释100倍所得到的溶液呈碱性,接近中性,故D错误;
故选B.
点评 本题考查溶液酸碱性判断,注意不能关键溶液pH判断溶液酸碱性,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,易错选项是D.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③⑤ | C. | ①②③④⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LCH3COOH溶液中:c(CH3COO-)=c(H+) | |
| B. | 水离出来的c(H+)=l.0×10-13 mol/L的溶液中,Al3+可能大量存在 | |
| C. | 0.1 mol/LNaHCO3溶液中:c(Na+)=c(HCO3- )+2c(CO3 2-)+c(H2CO3) | |
| D. | O.lmol/L的氨水中滴加稀盐酸至过量,不可能有:c(Cl-)>c(NH4 +)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

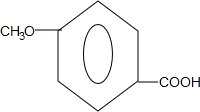 .
.
 )
) 合成丁香油酚的反应类型为取代反应.
合成丁香油酚的反应类型为取代反应.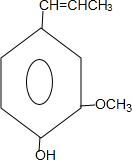 +CH3OCOCOCH3→
+CH3OCOCOCH3→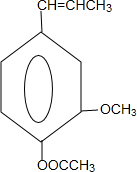 +CH3COOH
+CH3COOH .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.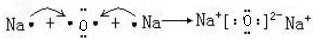 .
. .元素D在元素周期表中的位置是第三周期第VIIA族.
.元素D在元素周期表中的位置是第三周期第VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
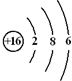 用电子式表示化合物 C2D 的形成过程
用电子式表示化合物 C2D 的形成过程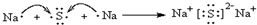
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 同种非金属元素间不可能形成离子键 | |
| C. | 非金属元素间不可能形成离子化合物 | |
| D. | 分子中一定存在共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com