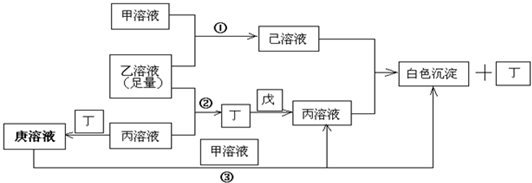
(2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.
(l) X、Z、W形成的化合物中含有的化学键类型为
离子键、共价键
离子键、共价键
;
(2)A是由Y、Z、W三元素共同构成的常见化合物,其水溶液呈碱性,用离子方程式表示其原因
CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-
CO32-+H2O═HCO3-+OH-、HCO3-+H2O═H2CO3+OH-
.写出表示溶液中所有离子浓度关系的等式
c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-)
c(Na+)+c(H+)═c(OH-)+2c(CO32-)+c(HCO3-)
(3)已知①M-M→2M△H=+a kJ?mol
-1 ②2X?→X-X△H=-b kJ?mol
-1③M?+X?→XM△H=-c kJ?mol
-1写出298K时,X
2与M
2反应的热化学方程式
H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1
H2(g)+Cl2(g)═2HCl(g);△H=(a+b-2c)KJ?mol-1
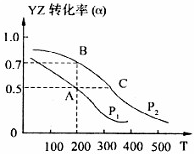
(4)若在密闭容器中充有10mol YZ与20mol X
2,在催化剂作用下反应生成甲醇,YZ的转化率(α)与温度、压强的关系如图所示
①P
l小于
小于
P
2(填“大于”、“小于”或“等于”)
②若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=
1(mol/l)-2
1(mol/l)-2
③若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间t
A大于
大于
t
C(填“大于”、“小于”或“等于”)
④在不改变反应物用量情况下,为提高YZ转化率可采取的措施是
降温、加压
降温、加压
(答出两点即可)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 (2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.
(2011?德州二模)短周期元素X、Y、Z、W、M原子序数依次增大.X是周期表中原子半径最小的元素,Y是形成化合物种类最多的元素,Z是自然界含量最多的元素,从是同周期中金属性最强的元素,M的负一价离子与Z的某种氢化物分子含有相同的电子数.




 HCO3-+OH-,使溶液呈碱性
HCO3-+OH-,使溶液呈碱性 HCO3-+OH-,使溶液呈碱性
HCO3-+OH-,使溶液呈碱性