
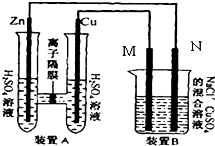
 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加| 6.5g |
| 65g/mol |
| 6.5g |
| 65g/mol |
| 0.2mol-0.05mol |
| 4 |
| 0.2mol-0.05×2mol |
| 2 |


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| 425 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中只存在Na+、Fe3+、SO42-,不可能存在K+、CO32- |
| B、由实验①无法推断原混合溶液中是否含有SO42- |
| C、由实验①、②可判断原混合溶液中是否含有Fe3+ |
| D、由实验③可判断原混合溶液中存在Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
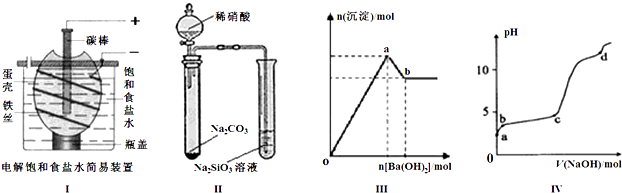
| A、按图Ⅰ装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B、按图Ⅱ装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
| C、图Ⅲ表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为: 2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D、图Ⅳ表示:室温时,将1mol?L-1 NaOH溶液逐滴滴入0.2mol?L-1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
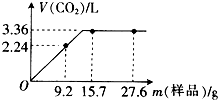 某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.
某同学用NaHCO3和KHCO3组成的混合物进行实验.现称取不同质量的该混合物溶于水后,分别滴入相同浓度的盐酸50mL,产生CO2气体的体积(标准状况下)与质量的关系曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com