
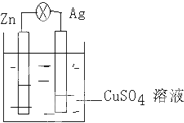
 在银锌原电池中,以硫酸铜为电解质溶液,
在银锌原电池中,以硫酸铜为电解质溶液,

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
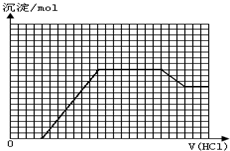 某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种.取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示.下列判断正确的是( )| A、原溶液中可能含有NH4+、SO42- |
| B、最终溶液中最少含2种溶质 |
| C、原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D、滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32g O2含有氧原子数为6.02×1023 |
| B、18g H2O在标准状况下的体积是22.4L |
| C、将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
| D、常温常压下,14g N2含有分子数为3.01×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2(g)+O2(g)═2N2O(g)△H=163 kJ?mol-1 |
| B、Ag(s)+Cl2(g)═AgCl(s)△H=-127 kJ?mol-1 |
| C、HgO(s)═Hg(l)+O2(g)△H=91 kJ?mol-1 |
| D、H2O2(l)═O2(g)+H2O(l)△H=-98 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com