
如图是CO2电催化还原为CH4的工作原理示意图,下列说法不正确的是

A.该过程是电能转化为化学能的过程
B.铜电极的电极反应式为CO2+8H++8e- =CH4+2H2O
C.一段时间后,①池中n(KHCO3)不变
D.一段时间后,②池中溶液的pH 一定下降
科目:高中化学 来源:2016-2017学年山西省高二12月月考化学试卷(解析版) 题型:选择题
生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其储存能量的能力是CO2的的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F-F | N-F |
键能/KJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的△H>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高一期中化学卷(解析版) 题型:选择题
将H2、 N2、O2三种气体分别放入不同容 器,使它们温度、密度相同,则其压强(p)大小的关系符合
器,使它们温度、密度相同,则其压强(p)大小的关系符合
A.p(H2)>p(O2)>p(N2) B.p(O2)>P(N2)>p(H2)
C.p(H2)>P(N2)>p(O2) D.P(N2)>p(O2)>p(H2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:填空题
I、铁及其化合物与生产、生活关系密切。
(1)右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.
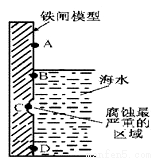
①该电化腐蚀称为___________。
②图中A、B、C、D四个区域,生成铁锈最多的是___________ (填字母)。
(2)己知:Fe(s)+O2(g)=FeO(s)H=-272.0kJ•mol-1
C(s)+O2(g)=CO2(g);△H=-393.5kJ•mol-1
2C(s)+O2(g)=2CO(g);△H=-221kJ•mol-1
则高炉炼铁过程中FeO(s)+CO Fe(S)+CO2(g) △H=____________。
Fe(S)+CO2(g) △H=____________。
II、甲醇是一种重要的化工原料和新型燃料。下图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
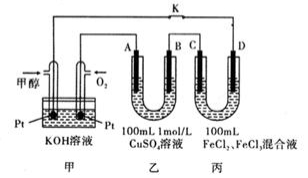
(1)甲中负极的电极反应式为_________________。
(2)乙中A极析出的气体在标准状况下的体积为_____________。
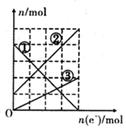
(3)丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系右图,则图中②线表示的是_____________离子的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要_________________mL 5.0 mol•L-1 NaOH溶液。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
已知分解1molH2O2放出热量98kJ,在含少量I-的溶液中,H2O2分解的机理为:H2O2→H2O +IO- 慢 H2O2+ IO-→H2O + O2+ I-快。下列有关该反应的说法正确的是
A.反应的速率与I-的浓度有关 B.IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上段考二化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的浓盐酸
B.常温下,NaOH溶液中由水电离出的C(H+)<1×10-7mol/L
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二11月月考化学试卷(解析版) 题型:选择题
在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol、b mol碘化氢(a>b),待反应2HI(g) I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
I2(g) + H2(g)达平衡后,下列说法肯定正确的是()
A. 从反应开始到建立平衡的平均速率:vA<vB
B. 平衡时I2的浓度:c(I2)A=c(I2)B
C. 平衡时碘蒸气在混合气体中的百分含置:A容器大于B容器
D. 平衡时HI的分解率:αA=αB
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州港区高一上11月月考化学卷(解析版) 题型:填空题
现有下列十种物质:①液态HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2 ⑦红褐 色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
色的氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH-===H2O,该反应的化学方程式为_____________________。
(2)⑩在水中的电离方程式为___________________________。
(3)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能
治疗胃酸过多,请写出其反应的离子方程式:________________________;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含Al(OH)3的胃药(如胃舒平),它与胃酸反应的离子方程式:________________________。
(4)写出下列反应的离子方程式
向Ba(OH)2溶液中逐滴加入稀硫酸________________________。
向Ba(OH)2溶液中通入过量的CO2_________________________。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期期中化学试卷(解析版) 题型:选择题
A是一种常见单质,B、C为常见化合物,A、B、C均含有元素X,它们有如下图的转化关系(部分产物及反应条件已略去)。下列判断不正确的是
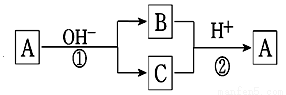
A.X元素可能为Al B.X元素一定为金属元素
C.反应①和②一定互为可逆反应 D.反应①和②一定为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com