
分析 (1)亚硫酸根离子水解生成亚硫酸氢根离子和氢氧根离子,溶液显示碱性,可以选用酚酞作为指示剂,然后通入给亚硫酸钠溶液加热,根据溶液红色深浅判断温度对该平衡的影响;
(2)醋酸为弱酸部分电离生成氢离子,溶液呈酸性,醋酸钠为弱酸的酸根离子,部分水解生成醋酸和氢氧根离子,溶液呈碱性,醋酸与醋酸钠混合溶液酸碱性取决于醋酸大电离程度与水解程度;
醋酸根Kh=$\frac{[HAc][OH{\;}^{-}]}{[Ac{\;}^{-}]}$=$\frac{[HAc][OH{\;}^{-}][H{\;}^{+}]}{[Ac{\;}^{-}][H{\;}^{+}]}$=$\frac{Kw}{Ka}$,据此判断其大小.
解答 解:(1)Na2SO3溶液中存在水解平衡:SO32-+H2O?HSO3-+OH-,所以Na2SO3溶液呈碱性,向溶液中滴加酚酞后,溶液变成红色,
加热后滴有酚酞的亚硫酸钠溶液的红色加深,证明亚硫酸钠的水解为吸热反应,加热后平衡SO32-+H2O?HSO3-+OH-向着正向移动,
故答案为:酚酞; 取Na2SO3溶液少许于试管中,滴加酚酞显红色,加热后溶液红色加深;
(2)醋酸为弱酸部分电离生成氢离子,溶液呈酸性,醋酸钠为弱酸的酸根离子,部分水解生成醋酸和氢氧根离子,溶液呈碱性,醋酸与醋酸钠混合溶液酸碱性取决于醋酸大电离程度与水解程度,混合溶液呈酸性,说明电离大于水解,所以醋酸的电离常数大于醋酸钠的水解常数;
醋酸根Kh=$\frac{[HAc][OH{\;}^{-}]}{[Ac{\;}^{-}]}$=$\frac{[HAc][OH{\;}^{-}][H{\;}^{+}]}{[Ac{\;}^{-}][H{\;}^{+}]}$=$\frac{Kw}{Ka}$,Ka小于1,所以Kh小于Kw,
故答案为:大于; 小于.
点评 本题考查了弱电解质电离、盐类水解,熟悉影响弱电解质电离的因素及电离常数表达式、盐类水解平衡表达式、水的离子积常数表示式之间关系是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
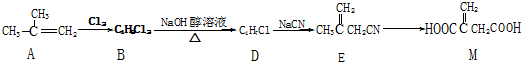
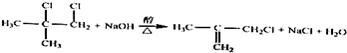
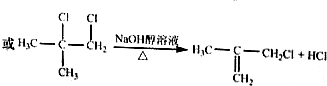 .
. (只写一种)
(只写一种)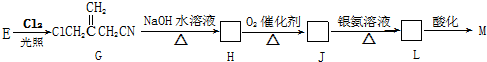
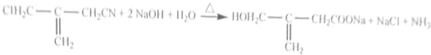
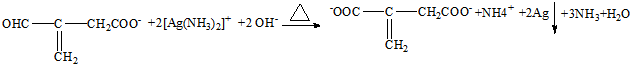
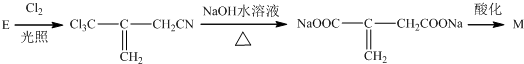 (实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)
(实例如图1);第二步反应试剂及条件限用NaOH水溶液、加热)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3 的水溶液:NaHCO3═Na++H++CO32- | |
| B. | 熔融状态的NaHSO4:NaHSO4═Na++HSO4- | |
| C. | HF的水溶液:HF═H++F- | |
| D. | H2S 的水溶液:H2S?2H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中的OH-向负极移动 | |
| B. | 在银表面上的反应为:Ag2S+2e-═2Ag+S2- | |
| C. | 在铝表面的反应为:Al-3e-═Al3+ | |
| D. | 在铝表面的反应为:Al+4OH--3e-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠可用于泡沫灭火剂 | B. | 明矾能做净水剂 | ||
| C. | 氯气可作自来水消毒剂 | D. | 铝热反应可用来焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指在恒压、恒温下,体系不做体积功,只做其它功的变化过程的热效应 | |
| B. | 书写热化学方程式时若不标明温度和压强,则表示是在0℃、101kpa条件下的反应热 | |
| C. | 化学反应中的能量变化,是由化学反应中化学键断裂时吸收的能量与生成物中化学键形成时放出的能量不同所导致的 | |
| D. | 吸热反应的△H<0,放热反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
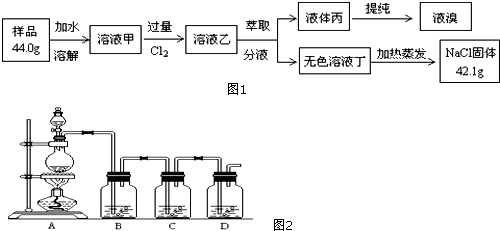
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com