
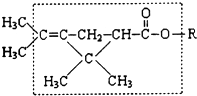
 大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )
大约在500年前,人们就注意到某些菊科植物的花蕾中存在有杀虫作用的物质.后经研究,凡具有下列方框内结构,且R不是H原子的有机物,就可能是一种高效、低毒、对昆虫有强烈触杀作用的杀虫剂.对此杀虫剂的下列叙述中正确的是( )| A. | 能发生加氢反应,但其生成物无杀虫作用 | |
| B. | 在酸性溶液中,此类杀虫剂将会失去杀虫作用 | |
| C. | 此类杀虫剂密封保存在碱溶液中,会丧失其杀虫作用 | |
| D. | 左端的甲基(-CH3)不可被替换为H,否则其替代物将失去杀虫作用 |
分析 该物质中含有碳碳双键、酯基,并结合烯烃和酯的性质及信息中具有图中方框内结构时具有杀虫作用,据此分析解答.
解答 解:A.含有双键能发生加成反应,但加成产物不具有图中方框内结构,则无杀虫作用,故A正确;
B.该物质含有酯基,酸性条件下水解后仍存在图中方框内结构,所以还具有杀虫作用,故B错误;
C.该物质含有酯基,在碱溶液中保存发生水解后仍存在图中方框内结构,所以还具有杀虫作用,故C错误;
D.左端的甲基(-CH3)替换为H,仍存在图中方框内结构,所以还具有杀虫作用,故D错误;
故选A.
点评 本题考查有机物结构和性质,侧重考查学生获取信息利用信息能力,明确信息中“具有下列方框内结构”是解答本题的关键,题目难度不大.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2S Na2O Na2SO3 | B. | Na2SO4Na2O Na2SO3 | ||
| C. | Na2O Na2S Na2SO4 | D. | Na2S Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,Fe3+与CO32-水解相互促进,使洗涤剂失去去污能力.
2H2O+O2↑,铁离子会加速H2O2分解,使洗涤剂失去杀菌作用;2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,Fe3+与CO32-水解相互促进,使洗涤剂失去去污能力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用含1mol FeCl3的溶液制备成Fe(OH)3胶体,其中胶粒数为NA | |
| B. | 12g金刚石中含有的共价键数为4 NA | |
| C. | 常温常压下,14 g CO和N2的混合气体中,含有原子数为NA | |
| D. | 1 L 1 mol/L NH4Cl溶液中含有NH4+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{C}$L | B. | $\frac{2A}{3C}$ L | C. | $\frac{2(A+B)}{3C}$ L | D. | $\frac{A+B}{C}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H=-485 kJ/mol | B. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g)△H=+485 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=-485 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24.2g | B. | 23.8g | C. | 23.2g | D. | 24.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com