
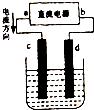
 图是电解CuCl2溶液的装置,其中c、d为石墨电极.
图是电解CuCl2溶液的装置,其中c、d为石墨电极.| 6.4g |
| 64g/mol |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| A、混合气体中氯气物质的量为0.04mol |
| B、混合气体中SO2物质的量为0.04mol |
| C、所得的沉淀为0.1mol BaSO4 |
| D、a的取值范围为0.896<a<1.792 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 在一定条件下,可逆反应xA+yB?zC达到平衡.若:
在一定条件下,可逆反应xA+yB?zC达到平衡.若:查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.
某化学实验小组想要了解市场所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L氢气中含有1 mol质子 |
| B、12g金刚石含有的共价键数为4NA |
| C、46g NO2和N2O4混合气体中含有原子总数为3NA |
| D、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20mL水 | B、浓盐酸 |
| C、冰醋酸 | D、NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com