
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
分析 A.发生反应为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,铁的物质的量为0.2mol,硝酸的物质的量为0.4mol,依据方程式可知铁过量,转移电子数依据硝酸的量计算;
B.依据n=$\frac{V}{{V}_{m}}$计算物质的量,结合乙烷分子结构计算含有的C-H极性共价键;
C.在NO2气体中存在平衡:2NO2?N2O4,导致气体体积偏小;
D.根据氢气的物质的量计算转移的电子数.
解答 解:A.发生反应为:3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,铁的物质的量为0.2mol,硝酸的物质的量为0.4mol,依据方程式可知铁过量,转移电子数依据硝酸的量计算,依据方程式可知消耗8mol硝酸生成2mol一氧化氮转移6mol电子,所以消耗0.4mol硝酸转移0.3mol电子,个数为0.3NA,故A错误;
B.标准状况下,11.2LC2H6的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合乙烷分子结构计算含有的C-H极性共价键=0.5mol×6×NA=3NA,故B正确;
C.一氧化氮和氧气不需要任何条件即可反应,由2NO+O2═2NO2,分子数减少,即分子总数小于0.5NA,故C错误;
D.铝与氢氧化钠溶液反应中氢元素化合价由+1价降低为0价,反应生成1mol氢气时,转移的电子数为1mol×2×NAmol-1=2NA,故D错误;
故选B.
点评 本题考查了考查阿伏加德罗常数的有关计算和判断,题目难度中等,阿伏加德罗常数是历年高考的“热点”问题,注意乙烷分子的结构.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发 | B. | 过滤 | C. | 萃取 | D. | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 | |
| D. | 电池正极反应式为:2MnO2+2e一+2H2O═2MnO (OH)+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
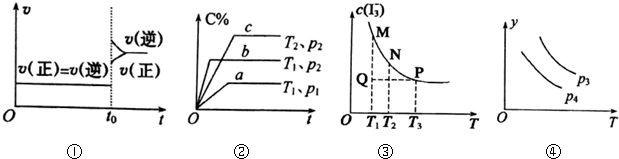
| A. | 图①对于达到平衡状态的N2(g)+3H2(g)?2NH3(g),在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 图②p2<p1,T1<T2 | |
| C. | 图③是反应:I2(aq)+I-(aq)?I3-(aq)的平衡体系中,I3-的物质的量浓度与温度(T)的关系图(曲线上的任何一点都代表平衡状态):Q点时,v正>v逆 | |
| D. | 图④对于反应2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Z的百分含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
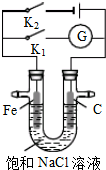
| A. | 只闭合K1,电流计G指针不发生偏转 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐降低 | |
| C. | 只闭合K2,电路中通过0.1mol电子时,两极共产生2.24L气体 | |
| D. | 只闭合K2,铁棒上发生的反应为:2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)CH3OH是一种可燃性的液体.
(1)CH3OH是一种可燃性的液体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
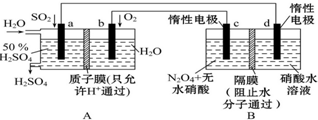 膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:
膜技术原理在化工生产中有着广泛的应用.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5(N2O5极易和水反应),装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
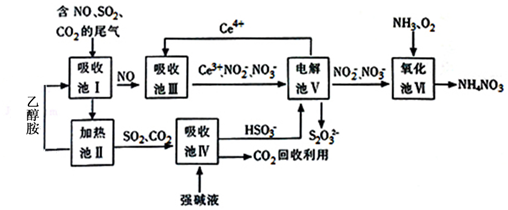
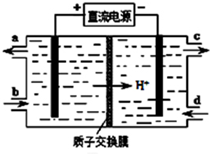
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com