
【题目】金属原子一般具有的特点是( )
A. 有金属光泽,能导电,有延展性
B. 熔点和沸点较低
C. 最外层电子个数少,容易失去
D. 在反应中作氧化剂
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.H2+CuO═Cu+H2O
B.2Na2O2+2H2O═4NaOH+O2↑
C.H2+Cl2═2HCl
D.2NaOH+Cl2═NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(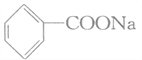 ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.7×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中除了添加NaA外,还需加压充入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.7×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中除了添加NaA外,还需加压充入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 提高CO2充气压力,饮料中c(A-)不变
C. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA)
D. 当pH为5.0时,饮料中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知碘(I)元素有﹣1、+l、+3、+5、+7等多种化合价,有些碘的氧化物可以看成是由带正电荷的碘离子和碘酸根离子(IO3﹣)构成.下列的化学式是碘酸碘的是( )
A.I2O5
B.I2O4
C.I4O5
D.I4O9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%浓硫酸配制2mol/L的稀硫酸,下列情况会使所配溶液浓度偏低的是
A. 未冷却就转移、定容 B. 容量瓶原有少量蒸馏水
C. 定容时俯视刻度线观察液面 D. 量筒取浓盐酸时,俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则醋酸体积__________氢氧化钠溶液体积 (填“>”“=”“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中c(Na+)___________c(CH3COO-)(填“>”“=”“<”)。
(3)某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a∶b___________;若所得混合液的pH=2,则a∶b___________。
(4)室温下,若某pH值的硫酸溶液中水电离的c(H+)=1.0×10-amol·L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-b mol·L-1,(已知a.b均小于14的正整数),那么a和b之间满足的数量关系是____________(用一个等式和一个不等式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________,正极的电极反应式是_________。
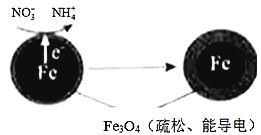
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是_______。
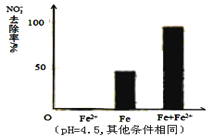
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________,加入Fe2+提高NO3-去除率的原因:____________。
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________。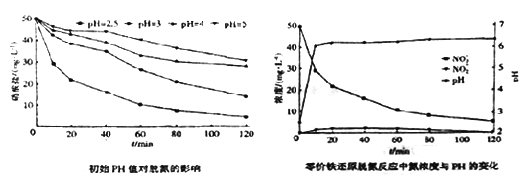
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com