
| A. | 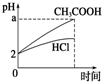 | B. | 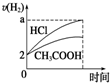 | C. | 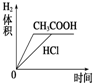 | D. | 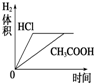 |
分析 n(HCl)=1L×0.01mol/L=0.01mol,n(Mg)=$\frac{0.12g}{24g/mol}$=0.005mol,则HCl与镁恰好反应,由于醋酸为弱酸,不能完全电离,则醋酸浓度大于盐酸,与镁反应时,醋酸过量,以此解答该题.
解答 解:n(HCl)=1L×0.01mol/L=0.01mol,n(Mg)=$\frac{0.12g}{24g/mol}$=0.005mol,
A.盐酸和镁恰好反应,醋酸为弱酸,反应后醋酸过量,溶液成酸性,则反应后醋酸pH较小,故A错误;
B.盐酸和镁恰好反应,醋酸过量,则镁完全反应,生产氢气体积相同,故B错误;
C.由于醋酸为弱酸,等pH时,醋酸浓度大,则醋酸反应较快,镁完全反应,生成氢气的体积相同,故C正确;
D..醋酸浓度较大,反应速率较大,故D错误.
故选C.
点评 本题考查酸与金属的反应及图象分析,明确酸的强弱、pH与浓度的关系、图象中纵横坐标的含义是解答本题的关键,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可使单位体积内活化分子数增多,反应速率加快 | |
| B. | 已知:C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3 kJ/mol,△S=+133.7 kJ/mol则该反应在低温下能自发进行 | |
| C. | 将FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| D. | 使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温度、同浓度两种溶液的pH:Na2CO3>NaHCO3 | |
| B. | 可以用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| C. | 由于NaHCO3溶液呈碱性,所以HCO3-在溶液中未电离 | |
| D. | 两种溶液中都存在:c(H+)+c(Na+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的烃,下列说法中不正确的是( )
的烃,下列说法中不正确的是( )| A. | 该烃是苯的同系物 | |
| B. | 该烃的一氯代物最多有3种 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有6个碳原子处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com