
| A. | NO的摩尔质量为30g | |
| B. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| C. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| D. | 设阿伏加德罗常数为NA,常温常压下O2与O3的混合物32g,含有分子数为NA |
分析 A.摩尔质量的单位为g/mol;
B.常温常压下,气体摩尔体积大于22.4L/mol;
C.过氧化钠和氧化钠均由2个钠离子和1个阴离子构成;
D.根据n=$\frac{m}{M}$求出臭氧和氧气的物质的量.
解答 解:A.摩尔质量的单位为g/mol,即NO的摩尔质量为30g/mol,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,故14gCO即0.5molCO,其体积大于11.2L,故B错误;
C.过氧化钠和氧化钠均由2个钠离子和1个阴离子构成,故等物质的量的两者中含有的阴阳离子的个数相等,故C正确;
D.32g臭氧的物质的量n=$\frac{m}{M}$=$\frac{32g}{48g/mol}$=$\frac{2}{3}$mol,32g氧气的物质的量n=$\frac{m}{M}$=$\frac{32g}{32g/mol}$=1mol,则常温常压下O2与O3的混合物32g,其物质的量介于$\frac{2}{3}$mol和1mol之间,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
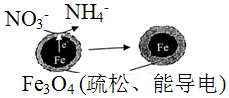
| A. | 能量转化形式主要为化学能转化为电能 | |
| B. | 电极材料分别为Fe和Fe3O4 | |
| C. | 负极反应为:NO3-+8e-+l0H+═NH4++3H2O | |
| D. | 该原理的总反应可表示为:NO3-+3Fe+2H++H2O═NH4++Fe3O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 抗酸药能中和胃里过多的盐酸,缓解胃部不适 | |
| B. | 柠檬因为有酸味,所以属于酸性食品 | |
| C. | 目前加碘食盐中碘元素以KIO3形式存在 | |
| D. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述I | 陈述Ⅱ |
| A | HClO具有强氧化性 | HClO有杀菌消毒作用 |
| B | 铝比铁活泼 | 铝比铁更容易被腐蚀 |
| C | 与水反应时,钠浮在水面上 | 钠与水反应是放热反应 |
| D | 浓硝酸具有强氧化性 | 浓硝酸能和浓氨水反应产生白烟 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| B. | 小苏打用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| D. | 纯净的二氧化硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g | B. | 2.8g | C. | 5.6g | D. | 11.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g乙烯中含有的电子总数为12NA | |
| B. | 1L0.1mol•L-1NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,若收集到11.2LCl2(标准状况),则至少转移电子数为NA | |
| D. | H2与Cl2反应生成22.4LHCl(标准状况),则断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com