
|
燃烧某混合气体,所产生的CO2的质量一定大于燃烧相同质量丙烯所产生的CO2的质量,该混合气体是 | |
| [ ] | |
A. |
丁烯、丙烷 |
B. |
乙炔、乙烯 |
C. |
乙炔、丙烷 |
D. |
乙烷、环丙烷 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:阅读理解
 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
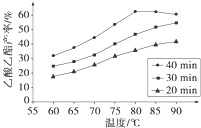 Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)
Ⅰ工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:CH3COOH(l)+C2H5OH(l)| 浓H2SO4 |
| △ |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| n(CO) | n(H2O) | n(H2) | n(CO2) | |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知2SO2(g)+O2(g)===2SO3(g),ΔH<0。生产中,为了提高SO2的转化率,依据化学平衡原理所确定的条件或措施有__________(填序号)。
a.原料在进入焚硫炉之前先粉碎?
b.使用V2O5作催化剂?
c.接触室中不使用很高的温度?
d.用过量的空气跟SO2反应?
e.接触氧化在常压下进行?
(2)如果生产98%的硫酸10 t,需要原料硫磺的质量为_______t,需要消耗空气的体积(标准状况)为_______m3。
(3)该厂每天消耗空气2.24×104 m3(标准状况),生产98%的硫酸a t。若在SO2催化氧化时不再补充空气,并假设生产过程中硫酸的产率为100%,当硫燃烧后的混合气体中氧气的体积分数为b时,a=_____________(用b表示),b的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省高三第二次月考理科综合化学试卷(解析版) 题型:填空题
(15分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g)
2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol—1
②H2O(I) === H2O(g) △H=+ 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 (2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
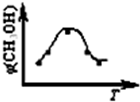
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,则上述CO2转化为甲醇的反应的△H1________0(填“>”、“<”或“=”)。(2分)

②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 (2分)。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为 (2分)。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________ (2分)
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________ 。(3分)(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)(2分)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省丹东市四校协作体高三摸底测试(零诊)理科综合试卷(化学部分) 题型:综合题
(15分)能源短缺是人类面临的重大问题。甲醇是一种可再生能源.具有广泛的开发和应用前景。因此甲醇被称为21世纪的新型燃料。
(1)已知在常温常压下:
①2CH3OH(I)十3O2(g)
2CO2(g)+4H2O(g) △H= _1275.6
kJ·mol—1
②H2O(I) === H2O(g) △H=+ 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 (2分).
(2)工业上一般采用下列两种反应合成甲醇:
反应A:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1
CH3OH(g)+H2O(g) △H1
反应B:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如下图所示,
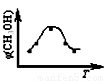
则上述CO2转化为甲醇的反应的
△H1________0(填“>”、“<”或“=”)。(2分)
②对于反应A,若容器容积不变,下列措施可增加甲醇产率的是 (2分)。
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
③某温度下,将4mol CO和12mol H2,充人2L的密闭容器中,充分反应,达到平衡后,测得c(CO) =0.5 mol·L—1,,则该温度下该反应的平衡常数为 (2分)。
④.某种甲醇—空气燃料电池是采用铂作为电极,稀硫酸作电解质溶液。其工作时负极的电极反应式可表示为______________________ (2分)
(3)对燃煤烟气中的SO2、NO2设物质的量之比为1∶1,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。,则该反应的化学方程式为________ 。(3分)
(4)在一定物质的量浓度的硝酸铵溶液中滴加适量的NaOH溶液,使溶液的pH=7,则
溶液中c(Na+)+c(H+)_____ c(NO3-)+c(OH-)(填写“>”“=”或“<”)(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com