
| A. | 硫酸型酸雨的形成涉及反应:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4 | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 常温下,0.1mol/L醋酸溶液pH≈3:CH3COOH?CH3COO-+H+ | |
| D. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 |
分析 A.亚硫酸易被氧化成硫酸,从而形成硫酸型酸雨;
B.亚硫酸为二元弱酸,电离方程式分步书写,主要以第一步电离为主;
C.醋酸为弱酸,在溶液中部分电离出醋酸根离子和氢离子;
D.铵根离子结合氢氧根离子,促进了氢氧化镁的溶解.
解答 解:A.亚硫酸易被氧化,反应的化学方程式为:2H2SO3+O2$\frac{\underline{\;催化剂\;}}{\;}$2H2SO4,从而易硫酸型酸雨,故A正确;
B.SO2溶于水生成亚硫酸,亚硫酸为二元弱酸,电离方程式只写出第一步即可,正确的反应为:SO2+H2O?H2SO3?H++HSO3-,故B错误;
C.常温下0.1mol/L醋酸溶液pH≈3,说明醋酸部分电离,其电离方程式为:CH3COOH?CH3COO-+H+,故C正确;
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),加入NH4Cl后,铵根离子结合氢氧根离子,平衡向着正向移动,导致氢氧化镁固体溶解,故D正确;
故选B.
点评 本题考查了化学方程式、离子方程式的正误判断,为高考的高频题,题目难度中等,注意掌握化学方程式、离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
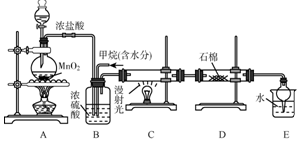 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
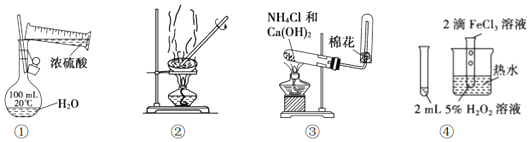
| A. | 用装置①配制一定浓度的硫酸溶液 | |
| B. | 用装置②分离溶解在CCl4中的 I2 | |
| C. | 用装置③制备和收集少量 NH3 | |
| D. | 用装置④验证FeCl3对 H2O2分解有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na>Mg | B. | 酸性:H2SO4>H2SiO3 | ||
| C. | 稳定性:HCl>HBr | D. | 同浓度溶液的碱性:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
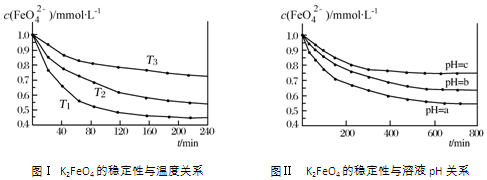
| A. | 由图Ⅰ可知K2FeO4的稳定性随温度的升高而减弱 | |
| B. | 由图Ⅰ可知温度:T1>T2>T3 | |
| C. | 由图Ⅰ可知上述反应△H<0 | |
| D. | 由图Ⅱ可知图中a<c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
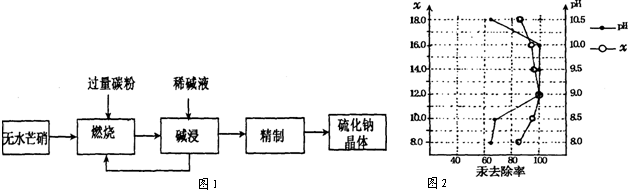
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,请完成下列空白:
,请完成下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com