
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作________极,甲中甲烷燃料电池的负极反应式为______________________________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为________ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、An等杂质)的电解精炼。下列说法正确的是________(填字母)。
A.a电极为纯铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________________________________________________________。
【答案】 阳 CH4+10OH--8e-===CO![]() +7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
+7H2O 4.48 AD 2Al+3H2O-6e-===Al2O3 + 6H+
【解析】(1)燃料电池中,负极上投放燃料,所以投放甲烷的电极是负极,则乙池中铁为阴极,C为阳极;负极上失电子发生氧化反应,电极反应式为:CH4+10 OH--8e-=CO32-+7H2O.
故答案为:阳;CH4-8e-+10 OH-═CO32-+7H2O;
(2)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() ×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
×4=0.4mol,乙装置中铁电极上氢离子放电生成氢气,设生成氢气的体积为xL;
2H++2e-=H2↑
2mol 22.4L
0.4mol xL
x=4.48,故答案为:4.48;
(3)电解精炼铜时利用了电解原理,电能转化为化学能,也有少量转化为热能;电解精炼时粗铜做阳极,发生氧化反应,精铜做阴极,阴极上发生还原反应;电解时,溶液中的阳离子发生变化,铜离子浓度逐渐减小,锌离子等浓度逐渐增大;粗铜中的不活泼金属不能失电子,以阳极泥的形式沉积在阳极附近,故答案为AD;
(4)电解池的阳极材料是铝时,则该电极反应是铝本身失电子的过程,即2Al+3H2O-6e-=Al2O3+6H+,阴极发生阳离子的得电子过程,在酸溶液中,为6H++6e-=3H2,故答案为:2Al+3H2O-6e-=Al2O3+6H+。


科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次(从左至右)发生的反应类型和反应条件都正确的是( )
选项 | 反应类型 | 反应条件 |
A | 加成反应、取代反应、消去反应 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去反应、加成反应、取代反应 | NaOH醇溶液/加热、常温、NaOH水溶液/加热 |
C | 氧化反应、取代反应、消去反应 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去反应、加成反应、水解反应 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱性的无色透明溶液中,能大量共存的离子是
A. Ca2+,Na+,NO3-,Cl- B. K+,Ba2+,Cl-,NO3-
C. Na+,HCO3-,CO32-,K+ D. Na+,Cl-,K+,MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是 ( )
A. 质量相等密度不等的NO和C2H6 B. 等体积不等密度的CO和C2H4
C. 等温等体积的O3和N2 D. 等压等体积的N2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可以提取到莽草酸,莽草酸有抗炎、镇痛作用,是合成某些抗癌药物的中间体。莽草酸的分子结构模型如图所示(分子中只有C、H、O三种原子)。下列有关莽草酸结构、性质叙述正确的是( )

A. 与氢气加成反应消耗氢气的物质的量为4mol.
B. 不能使溴水褪色,但能与氢气发生加成反应
C. 分子中同时含有羧基、羟基、碳碳双键三种官能团
D. 能与氯化铁溶液反应,溶液呈紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的结构简式为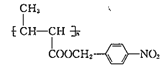 ,它的合成路线如下:
,它的合成路线如下:
![]()
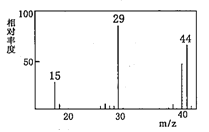
已知:① A是一种烃的含氧衍生物,它的质谱图如图。
②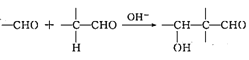
③ 醇容易被硝酸氧化。
(1)A的结构简式为_________。
(2)C中官能团的名称为_________。要检验C中的含氧官能团,下列可选用的试剂有________(填选项的字母)。
A.新制的氢氧化铜 B.溴水 C.酸性高锰酸钾溶液 D.浓硫酸
(3)E→F 的化学方程式为_________。
(4)① H物质的结构简式为_________。
② 以甲苯为原料,选用必要的无机试剂合成H,设计合成路线。(合成路线常用的表示方式为:![]() )__________
)__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应的平衡常数K1为________。
(2)100 ℃时达平衡后,将反应容器的容积增大一倍,平衡向________(填“正反应”或“逆反应”)方向移动,达到新的平衡后N2O4的浓度范围是___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com