
在一定条件下,在容积为2L的密闭容器中,将2mol 气体M和3mol N气体混合,发生如下反应:2M(g)+3N(g)⇌x Q(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4mol/L,下列有关叙述正确的是()
A. x值为2 B. 混合气体的密度增大
C. 平衡时N的浓度为0.3 mol/L D. N的转化率为20%
考点: 化学平衡的计算.
专题: 化学平衡专题.
分析: A.根据n=cV计算生成Q的物质的量,结合R的物质的量,利用物质的量之比等于化学计量数之比计算x的值;
B.容器的容积不变,混合气体的质量不变,根据ρ= 判断;
判断;
C.根据生成的R的物质的量,利用物质的量之比等于化学计量数之比计算参加反应的N的物质的量,N的平衡浓度= ;
;
D.根据C可知参加反应N的物质的量,N的转化率= ×100%.
×100%.
解答: 解:A.平衡时生成的Q的物质的量为0.4mol/L×2L=0.8mol,生成R为2.4mol,物质的量之比等于化学计量数之比,故0.8mol:2.4mol=x:3,解得x=1,故A错误;
B.反应体系中各组分都是气体,混合气体的质量不变,容器的容积恒定,根据ρ= 可知混合气体的密度不变,故B错误;
可知混合气体的密度不变,故B错误;
C.反应达到平衡时,生成2.4molR,由方程式可知,参加反应的N的物质的量为2.4mol,故平衡时N的物质的量为3mol﹣2.4mol=0.6mol,N的平衡浓度为 =0.3mol/L,故C正确;
=0.3mol/L,故C正确;
D.参加反应的N的物质的量为2.4mol,则N的转化率为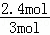 ×100%=80%,故D错误,
×100%=80%,故D错误,
故选:C.
点评: 本题考查化学平衡的有关计算,难度不大,侧重学生对基础知识的巩固.


科目:高中化学 来源: 题型:
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是( )
|
| A. | 分别加热这两种固体物质,并将生成的气体通入澄清石灰水中 |
|
| B. | 分别在这两种物质的溶液中,加入CaCl2溶液 |
|
| C. | 分别在这两种固体中,加入同浓度的稀盐酸 |
|
| D. | 分别在这两种物质的溶液中,加入少量澄清石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 一种烃在足量的氧气中燃烧并通过浓硫酸,减少的总体积就是生成的水蒸气的体积
C. 某气态烃CxHy与足量O2恰好完全反应(温度>100℃),如果反应前后气体体积不变,则y=4
D. 相同质量的烃,完全燃烧,消耗O2越多,烃中含H量越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是()
A. 工业上电解熔融的Al2O3冶炼铝用铁做阳极
B. 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2
C. 用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH
D. 用惰性电极电解浓CuSO4溶液一小段时间后,加入Cu2O固体可以使CuSO4溶液恢复原来浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同条件下,分别测得反应2SO2+O2⇌2SO3的速率如下,其中最快的是()
A. v(SO3)=4 mol•L﹣1•min﹣1 B. v(O2)=2 mol•L﹣1•min﹣1
C. v(SO2)=5 mol•L﹣1•min﹣1 D. v(SO2)=0.1 mol•L﹣1•S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是()
A. 增大浓度 B. 增大压强 C. 升高温度 D. 使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学反应速率的说法正确的是()
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100mL2mol•L﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5L 1mol/L FeCl3溶液中的Cl﹣的物质的量浓度为()
A. 3 mol/L B. 1.5 mol/L C. 1 mol/L D. 0.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
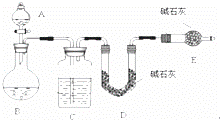
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数.
【方法一】测 SO2质量法采用如图所示装置,通过实验测定生成SO2的质量.
(1)C中盛放的试剂是 ,E装置的作用是
(2)若实验前称取m1g样品,再测得SO2的质量为m2g,则可得Na2SO4质量分数,其中m2是通过测定 (填装置符号)装置在实验前后的质量差得到的.该方法的缺点是(只答一点).
【方法二】测沉淀质量法
第一步:称取m3g样品,置于小烧杯中 第二步:向小烧杯中加入足量稀盐酸,加热
第三步:再向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤 第四步:干燥沉淀,称重为m4g
(3)简述洗涤沉淀的方法: .
(4)若m3=2m4 则试样中Na2SO4的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com