
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成.丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉.羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的空间构型为:_______;与SCN- 互为等电子体的分子有:__________________(填分子式)
(5)“NiO”晶胞如图:
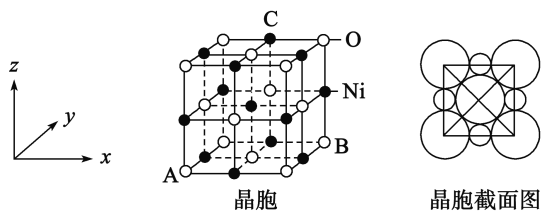
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)
【答案】3d84s2 sp2、sp3 丙烯醇中分子间存在氢键 O>C>Ni 三角锥形 N2O或CO2 ![]()
![]()
【解析】
根据晶胞参数相关信息计算分析解答;根据杂化轨道理论分析解答。
(1)Ni是28号元素,它的基态原子核外电子排布式为:[Ar] 3d84s2,则它的价电子排布式为:3d84s2,
故答案为:3d84s2;
(2) 丙烯醇中碳原子形成了一个碳碳双键,其余为碳氧、碳氢单键,所以C原子的杂化类型有sp2和sp3杂化,丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,是因为丙烯醇分子间存在氢键,
故答案为:sp2、sp3;丙烯醇中分子间存在氢键;
(3)同周期元素,从左到右电负性逐渐增强,同族元素,从上到下电负性逐渐减弱,则电负性:O>C>Ni,
故答案为:O>C>Ni;
(4) NH3分子中N原子是sp3杂化,且具有一对孤对电子,则NH3的空间构型为三角锥形,与SCN- 互为等电子体的分子有: N2O或CO2,
故答案为:三角锥形,N2O或CO2;
(5)①晶胞是正方体结构,且氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为(![]() ,1,1),
,1,1),
故答案为:(![]() ,1,1);
,1,1);
②已知氧化镍晶胞密度dg/cm3,设Ni2+ 半径为rnm,O原子半径为xnm,晶胞的参数为anm,一个晶胞中含有4个NiO,则m(晶胞)= ![]() g,V(晶胞)=a3,则可以得到(a×107)3·d=
g,V(晶胞)=a3,则可以得到(a×107)3·d=![]() ,a=
,a=![]() ×107nm,又因为晶胞对角线3个O原子相切,晶胞参数a=2x+2r,即4x=
×107nm,又因为晶胞对角线3个O原子相切,晶胞参数a=2x+2r,即4x=![]() a,x=
a,x=![]() a,带入计算可得到r=
a,带入计算可得到r=![]() =
=![]() ×
×![]() ×107nm,
×107nm,
故答案为:![]() ×
×![]() ×107nm。
×107nm。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间有如下转化关系: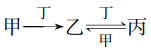 下列有关物质的推断不正确的是 ( )
下列有关物质的推断不正确的是 ( )
A. 若甲为AlC13溶液,则丁可能是NaOH溶液 B. 若甲为N2,则丁可能是O2
C. 若甲为Fe,则丁可能是稀硝酸 D. 若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
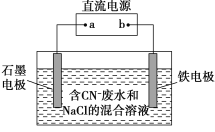
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO![]() +4H2O
+4H2O
下列说法正确的是
A.铁电极上发生的反应为Fe-2e-=Fe2+
B.通电过程中溶液pH不断增大
C.除去1 mol CN-,外电路至少需转移5 mol电子
D.为了使电解池连续工作,需要不断补充NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A.100mL1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
B.标准状况下22.4 L HF中含有的氟原子数目为NA
C.将1mol Cl2通入到足量的水中,则N(HClO)+N(Cl)+N(ClO)=2NA(N表示粒子数)
D.标准状况下,用MnO2和浓盐酸反应制取Cl2,当有4 molHCl被氧化时,生成44.8 LCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据量子力学计算,氮化碳结构有五种,其中一种β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列有关氮化碳的说法不正确的是
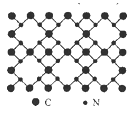
A. 该晶体中的碳、氮原子核外都满足8电子稳定结构
B. 氮化碳中碳显+4价,氮显-3价
C. 每个碳原子与四个氮原子相连,每个氮原子和三个碳原子相连
D. 氮化碳的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>![]() 碳化硅>晶体硅
碳化硅>晶体硅
D. 晶格能由大到小:NaF> NaCl> NaBr> NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图甲所示,表示强碱滴定强酸的滴定曲线
B. 图乙所示,从能量角度考虑,金刚石比石墨稳定
C. 图丙所示,表示反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
D. 图丁所示,图中的阴影部分面积的含义是[υ(正)-υ(逆)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
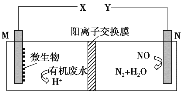
A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com