
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用沸点数据可以推测将一些液体混合物分离开来的可能性 | |
| B. | 通过比较溶度积常数(Ksp)与溶液中有关离子浓度幂的乘积--离子积(Qc)的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解 | |
| C. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 | |
| D. | 根据分散质粒子直径的大小,可以判断分散系的类别 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
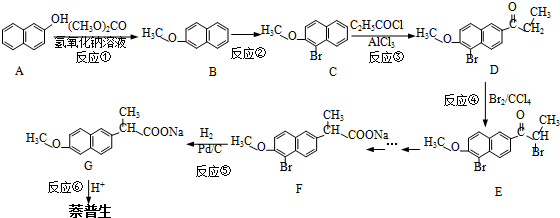
 )的化学性质与苯相似.
)的化学性质与苯相似. )外,最有可能生成的副产物(与H互为同分异构体)的结构简式是
)外,最有可能生成的副产物(与H互为同分异构体)的结构简式是 .
.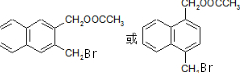 (任写一种).
(任写一种). 的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任用).(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B…$→_{反应条件}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
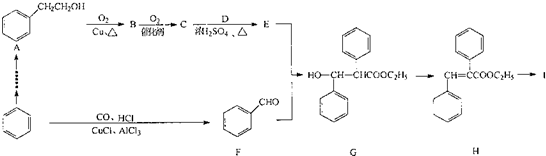
 .
. +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O:E+F--G的反应类型为加成反应.
+2H2O:E+F--G的反应类型为加成反应. +NaOH$\stackrel{△}{→}$C2H5OH+
+NaOH$\stackrel{△}{→}$C2H5OH+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 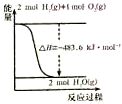 由图可知:H2的燃烧热为241.8kJ•mol-1 | |
| B. | 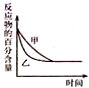 图中表示压强对反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙曲线对应的压强比甲的压强大 | |
| C. | 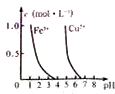 如图,若除去CuSO4溶液中的Fe2+,可向溶液中加入适量CuO,调节pH=4,过滤 | |
| D. | 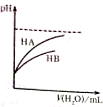 如图表示常温下HA、HB两种酸加水稀释时溶液pH的变化,则相同条件下,NaA溶液的pH大于NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 | |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 | |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 | |
| D | 稀盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | HCN | H2CO3 |
| 电离平衡常数(25℃) | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | Na2CO3溶液中滴入等体积、等浓度的盐酸后,溶液中一定存在:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(OH-) | |
| B. | Na2CO3溶液中通一定量的CO2气体后,溶液中一定存在:c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | |
| C. | Na2CO3溶液加水稀释后,c(H+)增大 | |
| D. | Na2CO3溶液中加入过量HCN,反应方程式为:Na2CO3+HCN=NaHCO3+NaCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
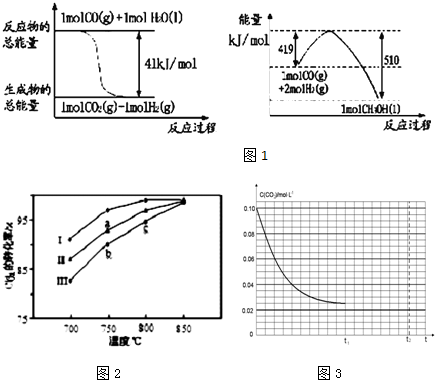
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com