
����Ŀ����KMnO4������Һ��������ͭ��Cu2S���Ͷ���������FeS2���Ļ����ʱ�������ķ�Ӧ����![]() +Cu2S+H+��Cu2++
+Cu2S+H+��Cu2++![]() +Mn2++H2O(δ��ƽ)�ͷ�Ӧ����
+Mn2++H2O(δ��ƽ)�ͷ�Ӧ����![]() +FeS2+H+��Fe3++
+FeS2+H+��Fe3++![]() +Mn2++H2O(δ��ƽ)������˵����ȷ���ǣ� ��
+Mn2++H2O(δ��ƽ)������˵����ȷ���ǣ� ��
A.��Ӧ����Cu2S�������������ǻ�ԭ��
B.��Ӧ����ÿ����1mol![]() ��ת�Ƶ��ӵ����ʵ���Ϊ10mol
��ת�Ƶ��ӵ����ʵ���Ϊ10mol
C.��Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��3
D.����Ӧ���ͷ�Ӧ�������ĵ�KMnO4�����ʵ�����ͬ����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ3��2
���𰸡�BD
��������
![]() ��MnԪ��Ϊ+7�ۣ�Cu2S��Cu��SԪ�طֱ�Ϊ+1��-2�ۣ�FeS2��Fe��SԪ�طֱ�Ϊ+2��-1�ۡ�
��MnԪ��Ϊ+7�ۣ�Cu2S��Cu��SԪ�طֱ�Ϊ+1��-2�ۣ�FeS2��Fe��SԪ�طֱ�Ϊ+2��-1�ۡ�
A����Ӧ����Cu2S��Cu��S�Ļ��ϼ۶����ߣ�����������Ӧ����Cu2SΪ��ԭ����MnԪ�صĻ��ϼ۽��ͣ�������ԭ��Ӧ��![]() Ϊ��������A����
��������A����
B����Ӧ����ÿ����1mol![]() ���μӷ�Ӧ��Cu2SΪ1mol��Cu2S���ϼ۹�����2(2-1)+(6+2)=10����Ӧת�Ƶ��ӵ����ʵ���Ϊ10mol��B��ȷ��
���μӷ�Ӧ��Cu2SΪ1mol��Cu2S���ϼ۹�����2(2-1)+(6+2)=10����Ӧת�Ƶ��ӵ����ʵ���Ϊ10mol��B��ȷ��
C����Ӧ����������![]() ���ϼ۽���(7-2)=5����ԭ��FeS2���ϼ۹�����1+2(6+1)=15�����ݵ�ʧ������ȣ��������뻹ԭ�������ʵ���֮��Ϊ15��5=3��1��C����
���ϼ۽���(7-2)=5����ԭ��FeS2���ϼ۹�����1+2(6+1)=15�����ݵ�ʧ������ȣ��������뻹ԭ�������ʵ���֮��Ϊ15��5=3��1��C����
D������Ӧ���ͷ�Ӧ�������ĵ�KMnO4�����ʵ�����ͬ�� 1molKMnO4�õ�5mol���ӣ�Cu2S���ϼ۹�����2(2-1)+(6+2)=10��Ӧ����0.5molCu2S��FeS2���ϼ۹�����1+2(6+1)=15��Ӧ����![]() mol=
mol=![]() mol FeS2����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ0.5mol��
mol FeS2����Ӧ���ͷ�Ӧ�������ĵĻ�ԭ�������ʵ���֮��Ϊ0.5mol��![]() mol=3��2��D��ȷ��
mol=3��2��D��ȷ��
��ѡBD��


 ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
ѧ�����νӽ̲��Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��R��T��Q��W��Ԫ�����ڱ��е����λ����ͼ��ʾ������T������������������������ȡ������жϲ���ȷ���ǣ� ��

A. �����̬�⻯������ȶ��ԣ�R��Q
B. ����������Ӧˮ��������ԣ�Q��W
C. ԭ�Ӱ뾶��T��Q��R
D. ����T��NaOH��Һ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪HCO3��+AlO2��+H2O�TCO32��+Al��OH��3������������KHCO3��Һ���ϵ��뺬�����ʵ�����KOH��Ba��OH��2��KAlO2�Ļ����Һ�У����ɳ��������ʵ���������KHCO3��Һ����Ĺ�ϵ�ɱ�ʾΪ�� ��
A.  B.
B.  C.
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�������ǰ�ɫ������ˮ�Ĺ�������ijС��������ͼװ�ã���װ�â���ͨ��CO2����ҺpH=7��Ȼ�����FeSO4��Һ�����ˡ�ϴ�ӡ������Ƶ�FeCO3��
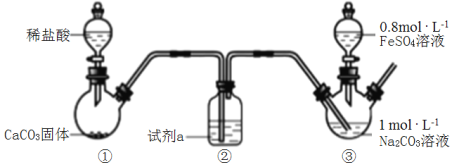
����˵��������ǣ� ��
A.�Լ�a�DZ���NaHCO3��Һ
B.̼������Һͨ��CO2��pH=7��Ŀ���ǽ���c(OH-)����ֹ����Fe(OH)2
C.װ�â������ɳ��������ӷ���ʽΪFe2++CO![]() =FeCO3��
=FeCO3��
D.̼������Һ�Լ��Ե�ԭ����CO![]() +H2OHCO
+H2OHCO![]() +OH-
+OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MnO2�ڵ�ء��������л��ϳɵȹ�ҵ������Ӧ�ù㷺�����ô�MnO2����������MnO��MnCO3����ȡ��MnO2��������ͼ��
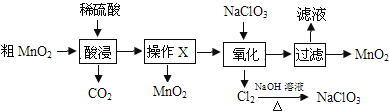
����˵��������ǣ� ��
A.���������ϡ�������ϡ���ᡢϡ�������
B.����X�������ǹ���
C.�������̷�����Ӧ�����ӷ���ʽΪ5Mn2++2ClO![]() +4H2O=5MnO2��+Cl2��+8H+
+4H2O=5MnO2��+Cl2��+8H+
D.���MnSO4��ҺҲ���Ƶ�MnO2�������缫ʽΪMn2+-2e-+2H2O=MnO2��+4H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ֽ�1mol H2O2�ų�����98kJ,�ں�����I-����Һ��,H2O2�ֽ�Ļ���Ϊ:
H2O2+I-��H2O+IO- ��
H2O2+IO-��H2O+O2+I- ��
�����йظ÷�Ӧ��˵����ȷ����( )
A.��Ӧ������I-Ũ����
B.IO-Ҳ�Ǹ÷�Ӧ�Ĵ���
C.�ֽ�2mol H2O2�ų�����196kJ
D.v(H2O2)=v(H2O)=v(O2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᰢ�ȶ����һ�������Σ�����Ҫ������ͨ���������в���֬Ĥ������ϸ�����ں϶���ϲ����ĸ��ƣ��ṹ��ͼ���ش��������⣺
(1)���ᰢ�ȶ��������N��O��S����Ԫ�ص�һ�������ɴ�С��˳��Ϊ___��Oԭ�Ӻ�����___�ֲ�ͬ�˶�״̬�ĵ��ӣ���̬Sԭ�ӵļ۵����Ų�ͼ����![]() ������Ϊ���Ų���ʽΥ����___��
������Ϊ���Ų���ʽΥ����___��
(2)�ýṹ��Nԭ�ӵ��ӻ���ʽ��___����֪�ڰ������У�H��N��H����Ϊ107.3����������[Zn(NH3)6]2+������H��N��H���DZ�Ϊ109.5��������ԭ��Ϊ___��
(3)���ᰢ�ȶ���в����еĻ�ѧ������Ϊ___(��ѡ����ĸ)��
A.���Ӽ� B.��λ�� C.������ D.���� E.���� F.���Լ� G.�Ǽ��Լ�
(4)�Ե�����(GaN)Ϊ�����ĵ������뵼�����Ŀǰ�ѳ�Ϊȫ��뵼���о���ǰ�غ��ȵ㡣GaN������ͼ1��ʾ��ͼ2Ϊ������y���ͶӰ1��1ƽ��ͼ��
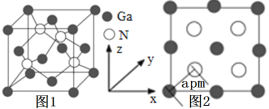
�ٵ������뵪���صĽṹ���ƣ��������۵�3000�棬�������۵�1700�棬���������۵㲻ͬ��ԭ��____��
�ھ�������һ��Gaԭ�Ӿ����������ȵ�Nԭ����____����
���谢���ӵ�������ֵΪNA����þ������ܶ���___g��cm3(�г��������ʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1 mol��L��1NaOH��Һ�ֱ�ζ�20.00mL 0.1 mol��L��1������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ����

A.��ֱ��ʾ����ʹ���ĵζ�����
B.pH=7ʱ���ζ�����ʹ�������NaOH��Һ��������
C.V(NaOH)=10.00mLʱ��������Һ��c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mLʱ������Һ��c(CH3COO-)> c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ijЩǿ���ε�ˮ��Һ�����ԣ���NaCl��Һ��ijЩ�����ε�ˮ��Һ�ʼ��ԣ���Na2CO3��Һ�����������ͼ��ʾת����ϵ�ش��й����⡣A��B��Ϊ��ɫ��Ӧ�ʻ�ɫ��ˮ��Һ��A�����ԣ�B�ʼ��Բ�����ǿ�����ԡ�

��1��д��C�Ļ�ѧʽ��________��
��2������д��A��D��D��E(E�к���ij��5��Ԫ�صĺ����������)�����ӷ���ʽ�� ___________________��_____________________��
��3��д����SO2����ͨ��K��Һ�з�����Ӧ�����ӷ���ʽ��____________��
��4������K��Һ�������ӵļ�������__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com