
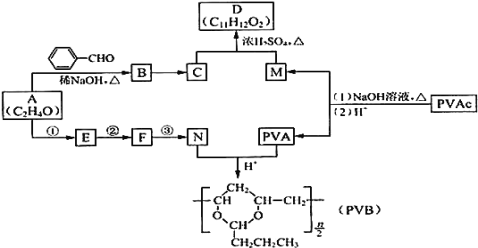
【题目】常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
已知:Ⅰ.RCHO+R’CH2CHO![]()
![]() +H2O(R、R’表示烃基或氢)
+H2O(R、R’表示烃基或氢)
Ⅱ.醛与二元醇![]() 如:乙二醇
如:乙二醇![]() 可生成环状缩醛:RCHO+HOCH2CH2OH
可生成环状缩醛:RCHO+HOCH2CH2OH![]()
 +H2O
+H2O
⑴A的核磁共振氢谱有两种峰.A的名称是 ______
⑵下列关于B的说法正确的是 ______
a.分子式为C9H8O b.所有原子均可在同一平面上
c.最多可以与5molH2发生反应 d.可以使溴水褪色
⑶C为反式结构,由B还原得到。C的结构简式是 ______
⑷G与D含有相同的官能团,相对分子量比D小28,则G的结构有 ______ 种![]() 不包括立体异构
不包括立体异构![]()
⑸E能使Br2的CCl4溶液褪色,N由A经反应①③合成。
a.②的反应类型是 ______
b.③的化学方程式是 ______
⑹PVAc由一种单体经加聚反应得到,该单体的结构简式是 ______
⑺碱性条件下,PVAc完全水解的化学方程式是 ______
【答案】乙醛 abcd ![]() 6 加成反应 2CH3(CH2)3OH+O2
6 加成反应 2CH3(CH2)3OH+O2 ![]() 2CH3(CH2)2CHO+2H2O CH3COOCH=CH2
2CH3(CH2)2CHO+2H2O CH3COOCH=CH2 ![]() +nNaOH
+nNaOH![]()
![]() +nCH3COONa
+nCH3COONa
【解析】
根据A的分子式和A转化为B的反应条件,结合题给信息I和A的核磁共振氢谱,可以确定A为乙醛,B为![]() ;由C为反式结构,由B还原得到,可以确定C中仍具有C=C,被还原的基团应是-CHO,由此即可确定C的结构式
;由C为反式结构,由B还原得到,可以确定C中仍具有C=C,被还原的基团应是-CHO,由此即可确定C的结构式![]() ;根据D的分子式C11H12O2,可以确定其不饱和度为6,结合生成D的反应条件,可确定D为
;根据D的分子式C11H12O2,可以确定其不饱和度为6,结合生成D的反应条件,可确定D为![]() ,进而确定M为乙酸;由PVB的结构简式和题给信息II可确定其单体之一是CH3(CH2)2CHO,即N为CH3(CH2)2CHO;另一高分子化合物PVA为
,进而确定M为乙酸;由PVB的结构简式和题给信息II可确定其单体之一是CH3(CH2)2CHO,即N为CH3(CH2)2CHO;另一高分子化合物PVA为![]() ,进而推出PVAc的单体为CH3COOCH=CH2;由A和N的结构简式,结合题给信息I即可推出E为CH3CH=CHCHO,F为CH3(CH2)3OH。
,进而推出PVAc的单体为CH3COOCH=CH2;由A和N的结构简式,结合题给信息I即可推出E为CH3CH=CHCHO,F为CH3(CH2)3OH。
⑴A的分子式是C2H4O,且A的核磁共振氢谱有两种峰,因此A只能是乙醛;
⑵B为![]() ,
,
a.B的分子式为C9H8O,故a正确;
b.苯环上、碳碳双键上及碳氧双键上所有原子共面,单键可以转动,所以B的所有原子均可在同一平面上,故b正确;
c.B中有一个苯环、一个碳碳双键、一个碳氧双键,所以最多可以与5molH2发生反应,故c正确;
d.B中有碳碳双键,可以使溴水褪色,故d正确;
故选abcd;
⑶C为反式结构,说明C中含有碳碳双键.又因为C由B还原得到,B中含有醛基,因此C中含有羟基,故C的结构简式是![]() ;
;
⑷D为![]() ,G与D含有相同的官能团,即含有酯基和碳碳双键,相对分子量比D小28,即少两个碳和四个氢,则G的结构为苯环上连有-CH=CHOOCH,或-COOCH=CH2,或-OOCCH=CH2,或连有-CH=CH2、-OOCH,这样的结构有邻间对三种,所以共有6种;
,G与D含有相同的官能团,即含有酯基和碳碳双键,相对分子量比D小28,即少两个碳和四个氢,则G的结构为苯环上连有-CH=CHOOCH,或-COOCH=CH2,或-OOCCH=CH2,或连有-CH=CH2、-OOCH,这样的结构有邻间对三种,所以共有6种;
⑸根据PVB的结构简式并结合信息Ⅱ可推出N的结构简式是CH3(CH2)2CHO,又因为E能使Br2的CCl4溶液褪色,所以E是2分子乙醛在氢氧化钠溶液中并加热的条件下生成的,即E的结构简式是CH3CH=CHCHO,然后E通过氢气加成得到F,所以F的结构简式是CH3(CH2)3OH,F过催化氧化得到N,方程式为2CH3(CH2)3OH+O2 ![]() 2CH3(CH2)2CHO+2H2O;
2CH3(CH2)2CHO+2H2O;
⑹根据上面的分析可知,PVAc的单体为CH3COOCH=CH2;
⑺PVAc为![]() ,含有酯基,能在碱性条件下水解生成
,含有酯基,能在碱性条件下水解生成![]() 和乙酸钠,反应的化学方程式为
和乙酸钠,反应的化学方程式为![]() +nNaOH
+nNaOH![]()
![]() +nCH3COONa。
+nCH3COONa。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.既有单质参加又有单质生成的反应一定是氧化还原反应
B.发生了颜色变化的一定是化学变化
C.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化
D.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是( )
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、SiO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组设计实验,测定![]() 与
与![]() 混合物中
混合物中![]() 的质量分数.
的质量分数.
甲方案:
实验步骤为:
![]() 称量空坩埚的质量为
称量空坩埚的质量为![]() ;
;![]() 称量装有试样的坩埚质量为
称量装有试样的坩埚质量为![]() ;
;
![]() 加热;
加热;
![]() 冷却;
冷却;
![]() 称量坩埚和残余物的质量为
称量坩埚和残余物的质量为![]() ;
;
![]() 重复
重复![]() 至
至![]() 操作,直至恒重,质量为
操作,直至恒重,质量为![]() 。
。
(1)坩埚中发生反应的化学方程式___________________________。
(2)计算![]() 质量分数为 _____________________________
质量分数为 _____________________________![]() 表达式
表达式![]() 。
。
乙方案:
准确称取![]() 样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用
样品,放锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用![]() 的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为
的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为![]() ,即
,即![]() 。重复上述操作两次。
。重复上述操作两次。
![]() 配制上述盐酸标准溶液100ml,若用
配制上述盐酸标准溶液100ml,若用![]() 进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。
进行配制,需用量筒量取该HCl溶液________ml;定容时俯视刻度线,将导致配制的溶液浓度________。![]() 填“偏高”、“偏低”或“没有影响”
填“偏高”、“偏低”或“没有影响”![]()
(4)根据下表数据,样品中![]() _________。
_________。![]() 保留三位有效数字
保留三位有效数字![]()
滴定次数 | 样品的质量 | 稀盐酸的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 |
|
|
|
2 |
|
|
|
3 |
|
|
|
丙方案:称取![]() 样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。

(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若分液漏斗中的水无法持续滴下,试判断装置A是否漏气?________![]() 填“漏气”、“不漏气”或“无法确定”
填“漏气”、“不漏气”或“无法确定”![]() 。实验时,装置A中c的作用_____________________,________________。
。实验时,装置A中c的作用_____________________,________________。
(6)为了提高测定的准确性,应选用装置A和_____![]() 填写字母标号
填写字母标号![]() 进行实验。
进行实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热的恒容密闭容器中,可逆反应![]() 达到平衡状态的标志是( )
达到平衡状态的标志是( )
①![]() ②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥
②各组分的物质的量不变 ③体系的压强不再发生变化 ④混合气体的密度不变 ⑤体系的温度不再发生变化 ⑥![]() ⑦3mol H-H键断裂的同时有2mol N-H键也断裂
⑦3mol H-H键断裂的同时有2mol N-H键也断裂
A.①②③⑤⑥B.②③④⑤⑥
C.②③⑤⑥D.②③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=9的氨水中:Na+、Al3+、NO3-、Cl-
B.0.1mol·L-1NaOH溶液中:K+、Na+、SO42-、CO32-
C.0.1mol·L-1FeCl3溶液中:K+、NH4+、Cl-、SCN-
D.![]() =1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
=1×1012的溶液中:Ca2+、Na+、S2-、MnO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
aA(g) |
| bB(g) |
| 2C(g) | |
起始物质的量浓度/(mol·L-1): | 1.5 | 1 | 0 | ||
2s末物质的量浓度/(mol·L-1): | 0.9 | 0.8 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为__。
②用物质B来表示0~2s的平均反应速率为__。
③从反应开始到2s末,A的转化率为__。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是__(填序号)
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是__。
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图,该燃料电池工作时,电池的总反应方程式为__;负极的电极反应式为__。
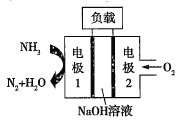
查看答案和解析>>
科目:高中化学 来源: 题型:
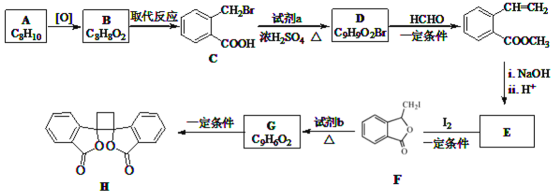
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如图所示:
已知:
![]()
![]() R—HC=CH—R’
R—HC=CH—R’
ii.R—HC=CH—R’![]()
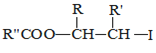
iii.R—HC=CH—R’![]()
![]() 以上R、
以上R、![]() 、
、![]() 代表氢、烷基或芳基等
代表氢、烷基或芳基等![]()
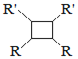
![]() 属于芳香烃,其名称是______。
属于芳香烃,其名称是______。
![]() 的结构简式是______。
的结构简式是______。
![]() 由F生成G的反应类型是______。
由F生成G的反应类型是______。
![]() 由E与
由E与![]() 在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
在一定条件下反应生成F的化学方程式是______;此反应同时生成另外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是______。
![]() 下列说法正确的是______
下列说法正确的是______![]() 选填字母序号
选填字母序号![]() 。
。
A.G存在顺反异构体
B.由G生成H的反应是加成反应
C.1molG最多可以与1mol![]() 发生加成反应
发生加成反应
D.1molF或1molH与足量NaOH溶液反应,均消耗2molNaOH
![]() 以乙烯为起始原料,结合已知信息选用必要的无机试剂合成
以乙烯为起始原料,结合已知信息选用必要的无机试剂合成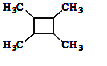 ,写出合成路线
,写出合成路线![]() 用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件
用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件![]() 。______。
。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com