
| ѡ�� | ʵ������ | ���ͻ���� |
| A | a��������b�������ɫ | �����ԣ�Cl2>Br2>I2 |
| B | c���ȱ�죬����ɫ | ������ˮ�������������� |
| C | d��������ɫ | ������ˮ������Ư�������� |
| D | e�����ɫ | ��ԭ�ԣ�Fe2��>Cl�� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na2SO3 | B��CaCl2 | C��AgNO3 | D��Na2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A | CH3CH3+Cl2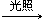 CH3CH2Cl+HCl CH3CH2Cl+HClCH2=CH2+HCl  CH3CH2Cl CH3CH2Cl | ��Ϊȡ����Ӧ |
| B | ����֬�õ����� �ɵ��۵õ������� | ��������ˮ�ⷴӦ |
| C | Cl2+2Br?=2Cl?+Br2 Zn+Cu2+=Zn2++Cu | ��Ϊ���ʱ���ԭ���û���Ӧ |
| D | 2Na2O2+2H2O+4NaOH+O2�� Cl2+H2O="HCl+HClO" | ��Ϊˮ����ԭ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ��� | ��ʵ | ���� |
| A | ����ˮ��Ӧ��Na��Mg���� | �����ԣ�Na > Mg |
| B | Ca(OH)2�ļ���ǿ��Mg(OH)2 | �����ԣ�Ca > Mg |
| C | SO2��NaHCO3��Һ��Ӧ����CO2 | �ǽ����ԣ�S > C |
| D | t��ʱ��Br2 + H2 2HBr K = 5.6��107 2HBr K = 5.6��107I2 + H2  2HCl K = 43 2HCl K = 43 | �ǽ����ԣ�Br > I |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
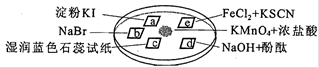
| A������ʵ��֤�������ԣ�MnO4����Cl2��Fe3+��I2 |
| B������ʵ���У���������������ԭ��Ӧ |
| C��ʵ������ɵ����岻��ʹʪ��ĵ���KI��ֽ���� |
| D��ʵ���֤��Fe2+�������������л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��H2S��I2��Fe3����Cl2 | B��Cl2��Fe3����I2��S |
| C��Fe3����Cl2��H2S��I2 | D��Cl2��I2��Fe3����H2S |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 FeCl2+I2��
FeCl2+I2�� 2Fe3++2Br-
2Fe3++2Br- 2CoCl2+Cl2��+3H2O,
2CoCl2+Cl2��+3H2O,| A���٢ڢ�����������ֱ���FeCl2��Fe3+��Cl2 |
| B���������Ϸ���ʽ���Եõ�������Cl2>Co2O3>Fe3+ |
| C���ڷ�Ӧ��������1 mol Cl2ʱ,��2 mol HCl������ |
D�����ݷ�Ӧ�٢�һ�����������õ�Cl2+FeBr2 FeCl2+Br2 FeCl2+Br2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com