
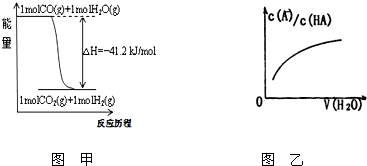
 关于下列各图的叙述不正确的是( )
关于下列各图的叙述不正确的是( )| 表 丙 | |
| 化学方程式 | 平衡常数K |
| F2+H2?2HF | 6.5×1095 |
| Cl2+H2=2HCl | 2.6×1033 |
| Br2+H2?2HBr | 1.9×1019 |
| I2+H2?2HI | 8.7×102 |
| A、已知1molCO燃烧放出的热为283kJ,2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol则图甲表示CO和H2O(g)生成CO2和H2的能量变化 | ||
| B、某温度下,pH=11的NH3?H2O和pH=1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3?H2O与NH3三种微粒的平衡浓度之和为0.045mol?Lˉ1 | ||
| C、在常温下,X2(g)和H2反应生成HX的平衡常数如表丙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐减小,且X2与H2反应的剧烈程度逐渐减弱 | ||
D、图乙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,
|


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
| A、用大米酿造的酒在一定条件下密封保存,时间越长越香醇 |
| B、欲将蛋白质从溶液中析出而又不改变它的性质,可加CuSO4溶液 |
| C、乙烯使溴水褪色与苯使溴水褪色的原因相同 |
| D、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
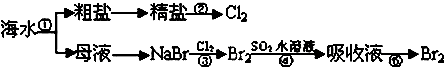
| A、实验室进行①的操作需用到坩埚、玻璃棒、酒精灯 |
| B、②是一个将电能转化为化学能的过程 |
| C、③④⑤涉及的反应均为氧化还原反应 |
| D、NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出时停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
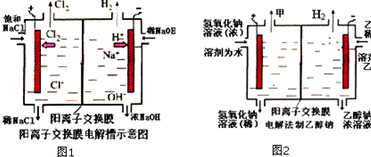 工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.
工业上生产氯气,常用电解槽电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分.如图1为电解槽的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
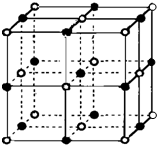 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ?mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾和氯气均可用于水的消毒、杀菌 |
| B、地沟油不能食用,但可以在循环经济中发挥作用 |
| C、硬铝属于合金材料,餐桌上的瓷盘属于硅酸盐制品 |
| D、不需要通过化学反应就能从海水中获得食盐和淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只存在乙酸分子中 |
| B、存在于乙酸乙酯、乙醇中 |
| C、只存在于乙醇分子中 |
| D、只存在于水分子中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com