
下列有关实验的说法正确的是()
A.在测定中和反应的反应热实验中,至少要读两次温度
B.可用pH试纸测定新制氯水的pH
C.中和滴定实验中,洗净后的锥形瓶不需要干燥
D.向CH3COONa溶液中滴入石蕊试液,溶液变蓝
E.向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,说明Ksp(ZnS)<Ksp(CuS)
考点: 化学实验方案的评价.
专题: 实验评价题.
分析: A.测定中和热实验中,需要测定酸溶液、碱溶液的温度及反应过程中的最高温度,每完成一次测量至少读三次温度;
B.新制的氯水中含有次氯酸,能够漂白pH试纸,无法测定出氯水的pH;
C.中和滴定过程中,锥形瓶中有少量的蒸馏水,不影响待测液中溶质的物质的量;
D.醋酸钠溶液为强碱弱酸盐,溶液显示碱性,所以石蕊试液变蓝;
E.白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,发生沉淀的转化.
解答: 解:A.在测定中和反应的反应热实验中,每完成一次中和热测定,至少需要读三次温度:反应前酸溶液、碱溶液的体积和反应中最高温度,故A错误;
B.新制的氯水中存在次氯酸,次氯酸具有强氧化性,能够漂白有色物质,所以无法用pH试纸测定新制氯水的pH,应选pH计测定,故B错误;
C.中和滴定实验中, 锥形瓶中有少量的蒸馏水,不影响待测液中溶质的物质的量,对测定结果没有影响,所以洗净后的锥形瓶不需要干燥,故C正确;
锥形瓶中有少量的蒸馏水,不影响待测液中溶质的物质的量,对测定结果没有影响,所以洗净后的锥形瓶不需要干燥,故C正确;
D.醋酸钠溶液中醋酸根离子水解,溶液为碱性溶液,所 以向CH3COONa溶液中滴入石蕊试液,溶液变蓝,故D正确;
以向CH3COONa溶液中滴入石蕊试液,溶液变蓝,故D正确;
E、向白色ZnS沉淀上滴加CuSO4溶液,沉淀变为黑色,发生沉淀的转化,说明硫化铜更难溶,可知二者溶度积关系为:Ksp(ZnS)>Ksp(CuS),故E错误;
故选CD.
点评: 本题考查化学实验方案的评价,为高频考点,涉及中和滴定、中和热的测定、难溶物的溶解平衡及沉淀转化、盐的水解原理等知识,把握物质的性质、反应原理及实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)⇌C(g)+D(g)已达平衡的是()
A. 混合气体的压强 B. 混合气体的密度
C. 混合气体的分子数目 D. 混合气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,在盛有稀 H2SO4 的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是()
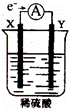
A. 外电路的电流方向为:X→外电路→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A. 无色溶液中:K+、H+、Fe2+、NO3﹣
无色溶液中:K+、H+、Fe2+、NO3﹣
B. c(H+)<c(OH﹣)的溶液中:Na+、K+、SO42﹣、ClO﹣
C. 含0.1mol•L﹣1 HCO3﹣的溶液中:Al3+、Ca2+、NO3﹣、SO42﹣
D. 含0.1 mol•L﹣1 SCN﹣的溶液中:Fe3+、NH4+、NO3﹣、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是( )
A. 水加热到很高的温度都难以分解
B. 水结冰成体积膨胀,密度减少
C. CH4、SiH4、GeH4、SnH4熔点随相对分子质量增加而升高
D. HF、HCI、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
图1是元素周期表的一部分,表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 .
(2)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填图2中的序号).
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是 (填化学式),试从结构角度加以解释: .
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于
晶体.
(5)i单质晶体中原子的堆积方式如图3(甲)所示,其晶胞特征如图3(乙)所示,原子之间相互位置关系的平面图如图3(丙)所示.
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 ,该晶体的密度为 (用M、NA、d表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐与碱反应制得白色纯净的Fe(OH)2沉淀.某研究性小组在研究制备Fe(OH)2的过程中,按图进行实验,最终在两极间的溶液中首先观察到白色沉淀.
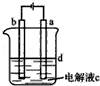
(1)请从所提供的试剂或电极材料中选择正确的序号填在横线上:
①纯水②NaCl溶液③NaOH溶液④四氯化碳⑤CuCl2溶液⑥乙醇⑦铁棒⑧植物油⑨碳棒
a为 ,b为 ,c为 ,d为 .(填序号)
(2)书写电极反应式:
阳极 ;.阴极 .
(3)c的作用是 .
(4)在加入c之前,对d溶液的简单处理应是 ,这样处理的目的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com