
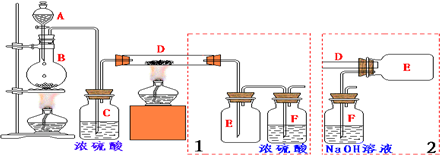
分析 实验室用氯气和金属铁反应制备无水三氯化铁:A为分液漏斗盛放浓盐酸,B为圆底烧瓶盛放二氧化锰,浓盐酸和二氧化锰加热制取氯气:4HCl(浓)+MnO2?$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,制取的氯气中含有水蒸气,C装置浓硫酸进行干燥氯气,装置D,在加热条件下,铁和氯气反应,反应方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,制得氯化铁.
(1)实验室用氯气和铁反应制取氯化铁,所以首先必须制取氯气,实验室常用浓盐酸和二氧化锰加热制取氯气,加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水;
(2)AB处是制取氯气,D是氯气和铁反应,所以先点B处酒精灯,B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;
(3)装置(Ⅰ)的主要缺点是导管易被产品堵塞,有毒气体应该有尾气处理装置;装置(Ⅱ)的主要缺点是:尾气处理装置中有水,导致氯化铁易潮解.
解答 解:(1)浓盐酸与二氧化锰在加热条件下生成氯气、氯化锰和水,化学方程式为4HCl(浓)+MnO2?$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,
故答案为:4HCl(浓)+MnO2?$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)D是氯气和铁反应,防止氧气和铁反应生成铁的氧化物而产生杂质,所以D中的反应开始前,必须排除装置中的空气,其方法是B中的反应进行一段时间后,看到共绿色气体充满装置,再开始加热D,
故答案为:充满黄绿色气体;
(3)装置(Ⅰ)的主要缺点是:导气管口较小,D装置中的固体物质易堵塞导管口;氯气是有毒气体,不能直接排空,否则会污染环境,所以应该有一个尾气处理装置,装置(Ⅱ):装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置,
故答案为:在E、F之间加入一个装有浓硫酸的洗气瓶.
点评 本题以氯化铁的制备为载体,考查了氯气的制备和性质的检验、实验装置的优劣分析,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺都符合绿色化学的思想
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.石油裂解、煤的气化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化
D.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物”,PM2.5在空气中只形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com