
(14分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答: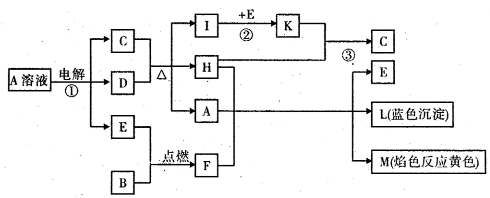
⑴写出化学式:A______ ; E______; L______
(2)反应①的离子方程式:________________________
⑶反应②,工业上釆取的反应条件是________________________
(4)反应③,工业上釆取的操作不是K直接与H反应,原因是__________________
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
第5页
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束震荡静止后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”, 来确定副产物中存在乙醚。请你对该同学的观点进行评价: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B原子的最外层电子数之和与C原子的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物常温下均为液态.请回答下列问题(填空时用实际物质的化学式表示):
(1)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式 ,其空间构型为 .
(2)科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 .
(3)C4分子结构如题26图所示,已知断裂lmol C-C吸收167kJ热量,生成1mo1C≡C放出942kJ热量.则下列说法正确的是 .
① C4属于一种新型的化合物 ② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量 ④ C2与C4互为同素异形体
⑤ C4与C2互为同分异构体
(4)已知A2(g)与C2(g)一定条件下反应生成0.5mol CA3(g)放出23kJ的热量,写出该反应的热化学方程式 .
(5)为了除去化合物乙(A2ED4)的稀溶液中混有的A2ED3,常加入氧化剂A2D2,发生反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源:2013届江苏省盐城市明达中学高三上学期学情调研考试化学试卷(带解析) 题型:填空题
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。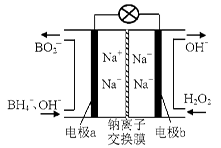
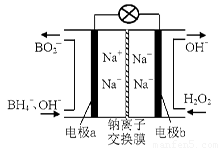
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。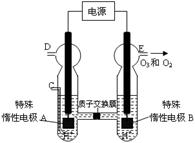
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx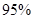 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) 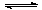 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是 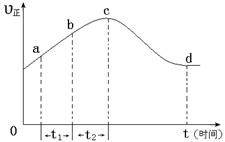
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城市高三上学期学情调研考试化学试卷(解析版) 题型:填空题
(14 分)过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如右图所示。该电池放电时正极的电极反应式为: ;
以MnO2做正极材料,可能是因为 。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢
为助燃剂。已知:
N2H4(g) + O2(g) = N2(g) + 2H2O(g) △H =" –" 534 kJ·mol-1
H2O2(l) = H2O(l) + 1/2O2(g) △H =" –" 98.64 kJ·mol-1
H2O(l) = H2O(g) △H=" +" 44kJ·mol-1
则反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H= 。
(3)O3 可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
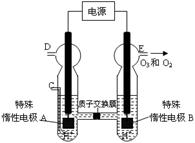
② 图中阴极为 (填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为: 。
③若C处不通入O 2 ,D、E处分别收集到15.68L和有6.72L气体(标准状况下),则E处收集的气体中O2和O3的体积之比为 (忽略 O 3 的分解)。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx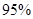 以上是以NO形式存在的,可发生反应NO(g)+ O3 (g)
以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) 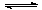 NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应 ,正反应速率随时间变化的示意图(如下图)所示。由图可得出的正确说法是
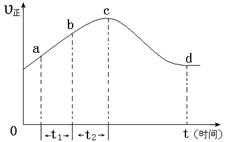
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2010年重庆市部分县市高三第三次诊断考试(理科综合)化学部分 题型:填空题
(14分)
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B原子的最外层电子数之和与C原子的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物常温下均为液态.请回答下列问题(填空时用实际物质的化学式表示):
(1)C与F两种元素形成一种化合物分子,各原子最外层达8电子结构,则该分子的结构式 ,其空间构型为 .
(2)科学家制出另一种直线型气态化合物 B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为 .
(3)C4分子结构如题26图所示,已知断裂lmol C-C吸收167kJ热量,生成1mo1C≡C放出942kJ热量.则下列说法正确的是 .

① C4属于一种新型的化合物 ② C4沸点比P4(白磷)低
③ lmol C4气体转变为C2吸收882kJ热量 ④ C2与C4互为同素异形体
⑤ C4与C2互为同分异构体
(4)已知A2(g)与C2(g)一定条件下反应生成0.5mol CA3(g)放出23kJ的热量,写出该反应的热化学方程式 .
(5)为了除去化合物乙(A2ED4)的稀溶液中混有的A2ED3,常加入氧化剂A2D2,发生反应的离子方程式为: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com