
| A. | AlO2-浓度为0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| B. | 室温下,pH=11的溶液中:Na+、Ba2+、AlO2-、NO3- | |
| C. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、CO32- | |
| D. | 由水电离的H+浓度为1×10-11mol•L-1的溶液中:Mg2+、NH4+、S2O32-、SO42- |
分析 A.AlO2-促进HCO3-的电离;
B.室温下,pH=11的溶液,显碱性;
C.加入KSCN溶液显红色的溶液,含铁离子;
D.由水电离的H+浓度为1×10-11mol•L-1的溶液,为酸或碱溶液.
解答 解:A.AlO2-促进HCO3-的电离,不能大量共存,故A错误;
B.室温下,pH=11的溶液,显碱性,该组离子之间不反应,可大量共存,故B正确;
C.加入KSCN溶液显红色的溶液,含铁离子与CO32-相互促进水解生成沉淀,不能大量共存,故C错误;
D.由水电离的H+浓度为1×10-11mol•L-1的溶液,为酸或碱溶液,碱性溶液中不能大量存在Mg2+、NH4+,酸溶液中H+、S2O32-发生氧化还原反应,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 用图甲所示装置制取并收集少量的N02气体(不考虑倒吸) | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置用苯萃取碘水中的碘,并将碘的苯溶液从漏斗下口放出 | |
| D. | 用图丁所示装置配制一定物质的量浓度的溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁沈阳东北育才学校高二阶段考一化学卷(解析版) 题型:选择题
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)  4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变
4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变 化关系如图.下列说法正确的是( )
化关系如图.下列说法正确的是( )
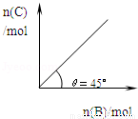
①若当温度升高后,则图中θ>45°
②若再加入B,则正、逆反应速率均逐渐增大
③若再加入B,则再次达到平衡时反应体系气体密度不变
④平衡时B的转化率为50%
A.①③ B.②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H=Q1 kJ/mol | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H=Q2 kJ/mol | K2 | 2.38 | 1.72 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g)△H=QkJ/mol | K | ? | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | V正减小,V逆增大 | B. | V正增大,V逆减小 | C. | V正V逆都增大 | D. | V正V逆都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能电离出氢离子的化合物叫做酸 | |
| B. | 能电离出氢氧根离子的化合物叫做碱 | |
| C. | 盐电离出的阳离子只能是金属阳离子 | |
| D. | 由金属离子和酸根离子组成的化合物属于盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com