
| A. | 溶液中n(KCl)=n(KClO)+5n(KClO3) | |
| B. | 参加反应的氯气的物质的量一定为0.15mol | |
| C. | 若反应中转移电子为nmol,则0.15mol<n<0.25mol | |
| D. | 共存体系溶液中,n(K+)、n(Cl-)可能为7:3 |
分析 形成KCl、KClO、KClO3共存体系,Cl元素的化合价由0降低为-1价,Cl元素的化合价由0升高为+1、+5价,Cl2既是氧化剂又是还原剂,结合原子守恒及电子守恒解答.
解答 解:A.由电子守恒可知,n(KCl)×(1-0)=n(KClO)×(1-0)+n(KClO3)×(5-0),则溶液中存在n(KCl)=n(KClO)+5n(KClO3),故A正确;
B.KCl、KClO、KClO3共存体系中K、Cl的原子个数相同,由原子守恒可知,参加反应的氯气的物质的量一定为0.03L×10mol/L×$\frac{1}{2}$=0.15mol,故B正确;
C.由K原子守恒可知若生成等物质的量的KCl、KClO,转移电子为0.15mol,若生成KCl、KClO3,二者物质的量比为5:1,转移电子为0.3mol×$\frac{1}{6}$×(5-0)=0.25mol,适当加热使溶液中形成KCl、KClO、KClO3共存体系,则反应中转移电子为nmol,可知0.15mol<n<0.25mol,故C正确;
D.KCl、KClO、KClO3共存体系中,KCl电离出Cl-,n(K+)、n(Cl-)为7:3,若7molK+,则生成KCl为3mol,得到电子为3mol,若只生成KClO失去电子为4mol,若只生成KClO3失去为4mol×5=20mol,一定不遵循电子守恒,故D错误;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化、电子和原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:填空题
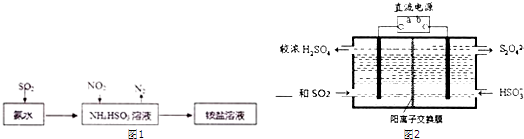
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
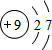 .元素⑩名称为溴.
.元素⑩名称为溴.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
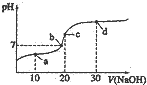 25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1
25℃时向20mL0.1 mol•L-1醋酸溶液中不断滴入0.1 | A. | a点:c(CH3COO-)<c(Na+) | |
| B. | 水的电离程度:c点小于d点 | |
| C. | b点时,NaoH和CH3COOH恰好完全反应 | |
| D. | d点:c(OH-)-c(H+)+c(CH3COOH)=0.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 | |
| B. | 研究采煤、采油新技术,提高产量以满足工业生产的快速发展 | |
| C. | 在农村推广使用沼气 | |
| D. | 减少资源消耗、增加资源的重复使用和资源的循环再生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com