
科目:高中化学 来源: 题型:填空题
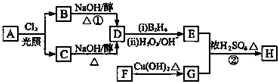
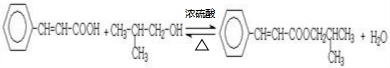
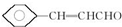 .
. ;
;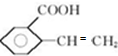 、
、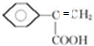 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

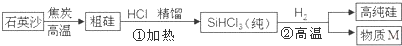
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.0018mol/L | C. | 0.075mol/L | D. | 0.0075mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 密度/(g•mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
| A. | 蒸馏 | B. | 升华 | C. | 分液 | D. | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;HCl.
;HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的离子半径比W的离子半径小 | |
| B. | 第一电离能:X<Y | |
| C. | Y的氢化物的沸点比Z的氢化物沸点高 | |
| D. | 室温时,WXY3在纯水存在沉淀溶解平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com