
在水中加等物质的量的Ag+、Pb2+、Na+、SO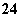 、NO
、NO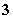 、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种 物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是
物质,甲、乙、丙含同一种元素。下列各组物质可按下图转化的是
| ① | ② | ③ | ④ | |
| 甲 | C | N2 | S | Fe |
| 丙 | CO2 | NO2 | SO3 | Fe(NO3)3 |
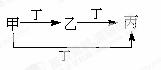
A.①② B. ②③ C.①④ D.③④
②③ C.①④ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
在N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图:
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关AgCl沉淀的溶解平衡说法正确的是( )
A.AgCl沉淀生成和沉淀溶解达平衡后不再进行
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl沉淀的溶解度增大
D.向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
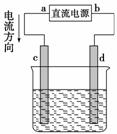
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是________________________________________________________________________
________________________________________________________________________。
(3)若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )

A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 Na2CO3溶液:[OH-]=[H+]+[HCO ]+2[H2CO3]
]+2[H2CO3]
B.0.1 mol·L-1 NH4Cl溶液:[NH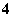 ]=[Cl-]
]=[Cl-]
C.向醋酸钠溶液中加入适量醋酸,得到酸性的混合溶液:
[Na+]>[CH3COO-]>[H+]>[OH-]
D.向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:
[Na+]=[NO ]+[Cl-]
]+[Cl-]
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据如表所示:
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是(双选)( )
A.500 s内N2O5的分解速率为2.96×10-3 mol·L-1·s-1
B.T1温度下的平衡常数K1=125,1 000 s时N2O5的转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)的浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1<T3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com