
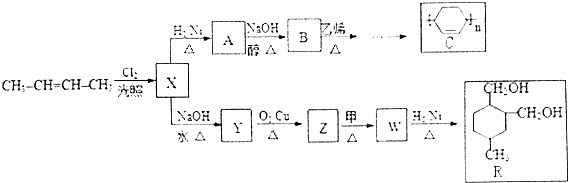
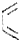 +
+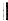 $\stackrel{△}{→}$
$\stackrel{△}{→}$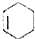
 .
.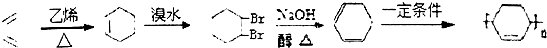 .(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物)
.(合成路线常用的表示方式为:A$→_{反应条件}^{反应试剂}$B$→_{反应条件}^{反应试剂}$…目标产物) 分析 2-丁烯与氯气在光照条件发生取代反应生成X,X与氢气发生加成反应生成A,A发生卤代烃的消去反应生成B,则B为CH2=CHCH=CH2,可推知X为ClCH2CH=CHCH2Cl,A为ClCH2CH2CH2CH2Cl.X发生水解反应生成Y为HOCH2CH=CHCH2OH,Y发生催化氧化生成Z为OHC-CH=CH-CHO,结合W与氢气的加成产物结构可知,Z与甲发生信息中的反应,可推知甲为CH2=CHC(CH3)=CH2,则W为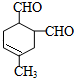 ,由C的结构简式可知,由B合成C,可以用B与乙烯发生信息中的反应生成环己烯,环已烯再与溴发生加成反应生成
,由C的结构简式可知,由B合成C,可以用B与乙烯发生信息中的反应生成环己烯,环已烯再与溴发生加成反应生成 ,
, 发生消去反应得
发生消去反应得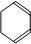 ,
, 发生加聚反应可得C,据此答题;
发生加聚反应可得C,据此答题;
解答 解:2-丁烯与氯气在光照条件发生取代反应生成X,X与氢气发生加成反应生成A,A发生卤代烃的消去反应生成B,则B为CH2=CHCH=CH2,可推知X为ClCH2CH=CHCH2Cl,A为ClCH2CH2CH2CH2Cl.X发生水解反应生成Y为HOCH2CH=CHCH2OH,Y发生催化氧化生成Z为OHC-CH=CH-CHO,结合W与氢气的加成产物结构可知,Z与甲发生信息中的反应,可推知甲为CH2=CHC(CH3)=CH2,则W为 ,
,
(1)B与乙烯发生反应的类型是加成反应,由上面的分析可知,甲为CH2=CHC(CH3)=CH2,
故答案为:加成反应;CH2=CHC(CH3)=CH2;
(2)A→B的反应为ClCH2CH2CH2CH2Cl的消去反应,反应的化学方程式为ClCH2CH2CH2CH2Cl+2NaOH$→_{△}^{醇}$CH2=CH-CH=CH2+2NaCl+2H2O,
故答案为:ClCH2CH2CH2CH2Cl+2NaOH$→_{△}^{醇}$CH2=CH-CH=CH2+2NaCl+2H2O;
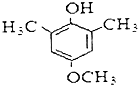
(3)W为 ,根据条件:①遇FeCl3溶液显紫色,但不能与浓溴水反应,说明有酚羟基,但羟基的邻对位上没有氢原子,②1H-NMR谱显示有四种不同化学环境的氢原子,即有4种位置的氢原子,则符合条件的W的一种同分异构体的结构简式为
,根据条件:①遇FeCl3溶液显紫色,但不能与浓溴水反应,说明有酚羟基,但羟基的邻对位上没有氢原子,②1H-NMR谱显示有四种不同化学环境的氢原子,即有4种位置的氢原子,则符合条件的W的一种同分异构体的结构简式为 ,
,
故答案为: ;
;
(4)A.A为ClCH2CH2CH2CH2Cl,不能使酸性KMnO4溶液褪色,故A错误;
B.W为 ,1molW生成1molR需要3mol的H2,故B错误;
,1molW生成1molR需要3mol的H2,故B错误;
C.Y为HOCH2CH=CHCH2OH,化合物Y属于酯类的同分异构体有丙酸甲酯、乙酸乙酯、甲酸丙酯和甲酸异丙酯,共有4种,故C正确;
D.根据R的结构简式可知,化合物R分子式为C9H18O2,故C正确,
故选AB;
(5)由B合成C,可以用B与乙烯发生信息中的反应生成环己烯,环已烯再与溴发生加成反应生成 ,
, 发生消去反应得
发生消去反应得 ,
, 发生加聚反应可得C,合成路线为
发生加聚反应可得C,合成路线为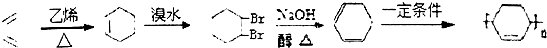 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,理解Diels-Alder反应原理是关键,结合D的结构及W的加成产物进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向Na2SiO3溶液中滴加几滴酚酞,然后逐滴加入稀盐酸至红色褪去,2min后,试管里出现凝胶 | 非金属性:Cl>Si |
| B | 取久置的Na2O2粉末,向其中滴加过量的盐酸后产生气体 | Na2O2没有变质 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液,未出现淡黄色沉淀 | 溴乙烷没有水解 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | B与混合气体的体积比 | 反应后气体密度(已换算为标准状况;g/L) |
| 第一次 | 1.0 | 1.35 |
| 第二次 | 1.2 | 1.25 |
| 第三次 | 2.0 | 1.04 |
| 第四次 | 2.2 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(6)(8)(9)(11) | B. | (2)(3)(6)(10)(11)(13) | C. | (3)(8)(9)(10)(11)(12) | D. | (4)(5)(7)(10)(11)(14) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将钠投入到足量水中 | |
| B. | 将钠用铝箔包好并刺一些小孔,再放入足量水中 | |
| C. | 将钠放入足量稀硫酸中 | |
| D. | 将钠放入足量碳酸氢钠溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com