
【题目】一定条件下,![]() 与
与![]() 发生反应:
发生反应:![]() ,设起始
,设起始![]() ,在恒压下,平衡时
,在恒压下,平衡时![]() 的体积分数与Z和
的体积分数与Z和![]() 温度
温度![]() 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. 该反应的焓变![]()
B. 图中X点对应的平衡混合物中![]()
C. 图中Z的大小为![]()
D. 温度不变时,图中X点对应的平衡在加压后![]() 增大
增大
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )

A. Ⅱ表示的是滴定醋酸的曲线
B. V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
C. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
D. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成HClO,遇有机物易燃烧或爆炸,42℃以上易分解。某化学兴趣小组设计如图装置以制备Cl2O(支撑及夹持装置已省略)。

已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。 ②Cl2O的部分性质如下表。
熔点 | 沸点 | 制备方法 |
-120.6 ℃ | 3.8℃ | 2HgO+2Cl2 = Cl2O+HgCl2·HgO |
请回答:
(1)指出该制备装置中存在的一个明显错误______________(经改进后进行有关实验)。
(2)装置C中盛有的试剂是______________。
(3)写出装置A中制备Cl2的化学方程式__________。
(4)装置D中采用18℃~20℃水浴的原因之一是如温度过低,反应速率慢,另一个可能的原因是 ___________。
(5)装置D、E间的连接方式与A、B、C间的连接方式有明显的差别,装置D、E间采用这种连接方式的理由是____________。
(6)Cl2O是市场上一种比较理想的饮水消毒剂,ClO2和Cl2O在消毒时自身均被还原为Cl-,则ClO2消毒能力是等质量Cl2O的_________倍(结果保留两位小数)
(7)文献报道说,Cl2O的另一种制备方法是利用Cl2与足量的Na2CO3溶液反应来制得,写出该反应的化学方程式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制100mL 0.2 mol·L-1的Na2CO3溶液,试回答下列问题:
(1)若要实施配制,除天平、烧杯、玻璃棒外,还需的玻璃仪器有________, ________;
(2)配制完毕后,教师指出有三位同学进行了下列某一项错误操作,你认为这三项错误操作中会导致所得溶液浓度偏高的是________(填选项字母)
A.定容时仰视容量瓶刻度线
B.定容时俯视容量瓶刻度线
C.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度线
(3)通过计算得出可用天平称取Na2CO3固体________g。若用4 mol·L-1的Na2CO3浓溶液配制100 mL 0.2 mol·L-1的稀溶液,应用量筒量取______mL该浓溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化钛是生产金属钛及其化合物的重要中间体。某校化学课外活动小组准备利用下图装置制备四氯化钛(部分夹持仪器已略去)。

资料表明:室温下,四氯化钛为无色液体,熔点:-25 ℃,沸点:136.4 ℃。在空气中发烟生成二氧化钛固体。在650~850 ℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。回答下列问题:
(1)实验时在仪器中加试剂前要先___________________________。
(2)实验中分液漏斗上口玻璃塞连接导管的作用是__________________________________ B装置的作用是_____________________________。
(3)写出D装置中物质制备的化学方程式________________________________;写出四氯化钛在空气中发烟的化学方程式______________________________。
(4)E装置作用是_______________________。
(5)F装置中盛装的物质是________。
(6)该实验设计略有缺陷,请指出其不足之处:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其相关性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是______________(填序号)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)写出制备Fe(OH)3胶体的化学反应方程式:________________。
(3)怎样证明制得的物质是胶体?请简述操作过程:__________________。
(4)取少量制得的胶体加入试管中,再加入少量(NH4)2SO4溶液,观察到的现象是__________, 这种现象称为胶体的________________。
(5)Fe(OH)3胶体能稳定存在的主要原因是________(填序号)。
A. 胶粒直径小于1nm B. 胶粒带正电荷
C. 胶粒作布朗运动 D . 胶粒能透过滤纸
(6)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________(填序号)。
A. Fe(OH)3胶体粒子的直径在1~100nm之间
B. Fe(OH)3胶体具有丁达尔效应
C. Fe(OH)3胶体是均一的分散系
D. Fe(OH)3胶体的分散质粒子能透过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图,回答问题。
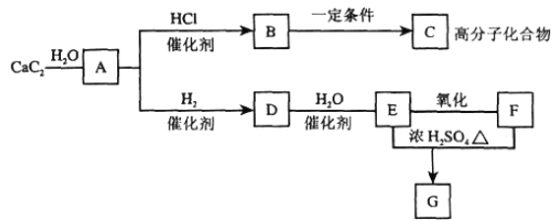
(1)有机物的结构简式:C._________________, E_______________。
(2)①反应DE的化学方程式是___________________________________________。
②E和F反应生成G的化学方程式是_______________,反应类型为__________。
③实验室制取A的化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G可用来制备抗凝血药,可通过下列路线合成。
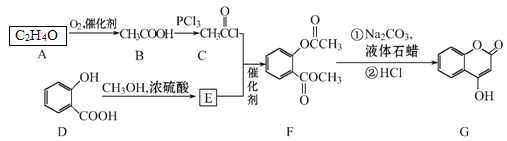
请回答:
(1)C+E→F的反应类型是____。
(2)F中含有的官能团名称为____。
(3)在A→B的反应中,检验A是否反应完全的试剂为_____。
(4)写出G和过量NaOH溶液共热时反应的化学方程式_____。
(5)化合物E的同分异构体很多,符合下列条件的结构共____种。
①能与氯化铁溶液发生显色;②能发生银镜反应;③能发生水解反应
其中,核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的结构简式为___。
(6)E的同分异构体很多,所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器是___(填标号)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(7)已知酚羟基一般不易直接与羧酸酯化。苯甲酸苯酚酯(![]() )是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
)是一种重要的有机合成中间体。请根据已有知识并结合相关信息,试写出以苯酚、甲苯为原料制取该化合物的合成路线流程图(无机原料任选)。____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com