
| A. | Na2FeO4消毒、杀菌时得到的Fe3+可以净水,Fe3+能产生净水物质的原因是:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| B. | 工业上可用FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,化学方程式为:2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O | |
| C. | Na2FeO4在酸性溶液中不稳定,与水反应生成Fe3+和O2,离子方程式为:4FeO42-+10H2O═4Fe3++20OH-+3O2↑ | |
| D. | 工业上可用铁做阳极,电解浓NaOH溶液的方法制Na2FeO4,阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O |
分析 A.Na2FeO4还原产物为Fe3+,Fe3+水解得到胶体;
B.FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,发生氧化还原反应,Cl元素得到电子生成NaCl;
C.酸性溶液中不能生成氢氧根离子;
D.铁做阳极,Fe失去电子.
解答 解:A.Na2FeO4还原产物为Fe3+,Fe3+水解得到胶体,水解离子反应为Fe3++3H2O?Fe(OH)3(胶体)+3H+,故A正确;
B.FeCl3、NaOH、NaClO三种物质反应制得Na2FeO4,发生氧化还原反应,Cl元素得到电子生成NaCl,由电子、原子守恒可知,反应为2FeCl3+10NaOH+3NaClO═2 Na2FeO4+9NaCl+5H2O,故B正确;
C.酸性溶液中不能生成氢氧根离子,则离子方程式为4FeO42-+20 H+═4Fe3++10H2O+3O2↑,故C错误;
D.铁做阳极,Fe失去电子,则阳极的电极反应为:Fe-6e-+8OH-═FeO42-+4H2O,故D正确;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,把握习题中的信息、氧化还原反应及水解原理是解答本题的关键,侧重分析与应用能力的考查,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 16O和18O在自然界的含量保持不变 | |
| B. | 16O和18O的质量数不同,质子数相同 | |
| C. | 16O和18O可以通过化学反应相互转化 | |
| D. | 16O和18O核外电子数相同,化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
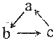 的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | NO | Fe | Al |
| b | CuCl2 | NO2 | FeCl3 | Al(OH)3 |
| c | Cu | HNO3 | FeCl2 | AlO2- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
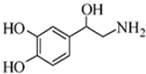
| A. | 该有机物的分子式是C8H10NO3 | |
| B. | 1mol该有机物最多能与2molBr2发生反应 | |
| C. | 该有机物不能与Na2CO3溶液反应 | |
| D. | 该有机物既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
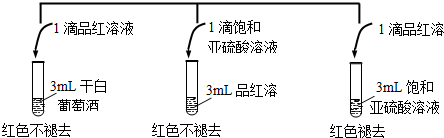
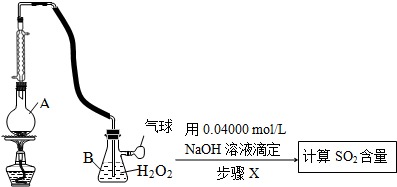
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
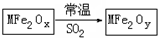 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )| A. | x<y | B. | SO2是该反应的催化剂 | ||
| C. | MFe2Ox是还原剂 | D. | 氧化性:MFe2Oy>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com