
С����ʵ��ʱ��С��մ��һЩKMnO4��Ƥ���ϵĺڰߺܾò�������������ò����ϡ��Һϴ�����Ͽ��Ը�ԭ�������ӷ���ʽΪ��MnO4��+H2C2O4+H+��CO2��+Mn2++����δ��ƽ�������ڴ˷�Ӧ��������ȷ���ǣ�������
| �� | A�� | �÷�Ӧ����������H2C2O4 | B�� | 1molMnO4���ڷ�Ӧ��ʧȥ5mol���� |
| �� | C�� | �÷�Ӧ�ҿ��ڵIJ�����OH�� | D�� | ��ƽ�÷�Ӧ��H+�ļ�������6 |
| ������ԭ��Ӧ����ʽ����ƽ��������ԭ��Ӧ�ĵ���ת����Ŀ���㣮. | |
| ר�⣺ | ������ԭ��Ӧר�⣮ |
| ������ | A�����ϼ۽��͵�Ԫ�����ڷ�Ӧ������������ B�����ϼ�����Ԫ��ʧȥ���ӣ����ϼ�������=ʧȥ���ӵ���Ŀ�� C������ԭ���غ㡢�����غ�͵���غ�����ƽ���ӷ���ʽ�� D������ԭ���غ㡢�����غ�͵���غ�����ƽ���ӷ���ʽ�� |
| ��� | �⣺A�����ϼ۽��͵�Ԫ������Ԫ�أ����ڷ�Ӧ��KMnO4������������A���� B����Ԫ�ػ��ϼ۴�+7�۽��͵�+2�ۣ�Ԫ�صõ����ӣ����ϼ۽�����=�õ����ӵ���Ŀ=5����1molMnO4���ڷ�Ӧ�еõ�5mol���ӣ���B���� C�����ݵ����غ㣬�÷�Ӧ����Ԫ�ػ��ϼ۽���5�ۣ���̼Ԫ�ػ��ϼ۹�����2�ۣ����Է�Ӧת�Ƶ�����Ϊ10�����Կ��Եõ���2MnO4��+5H2C2O4+H+��10CO2��+2Mn2++�������ݵ���غ㡢ԭ���غ㣬���ԡ���Ϊ8H2O��H+�ļ�������6����C���� D������ԭ���غ㡢�����غ�͵���غ�����ƽ���ӷ���ʽΪ��2MnO4��+5H2C2O4+16H+�T10CO2��+2Mn2++8H2O��H+�ļ�������16����D��ȷ�� ��ѡD�� |
| ������ | ���⿼��ѧ��������ԭ��Ӧ�е��ۺ�֪ʶ��Ҫ��ѧ�����з����ͽ��������������ѶȽϴ� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ�����ﳣ�ø�����У���Ũ����(98%)������ˮ�Ȼ��ƣ��۱�ɫ�轺[�轺����Ҫ�ɷ��Ƕ������裬�����в�����������ˮ�Ȼ���(CoCl2)��ָʾ������ˮ�Ȼ��ܳ���ɫ����ˮ���ΪCoCl2·6H2O���ʷۺ�ɫ]�������������ף��ݼ�ʯ��(��Ҫ�ɷ����������ơ������ƣ��Ʒ��ǣ�����ʯ�Ҽӵ�Ũ���ռ���Һ�У��ټ�ǿ������)�ȡ�
��1��д����ȡ�������ʯ�ҹ� �����йط�Ӧ�Ļ�ѧ����ʽ��
�����йط�Ӧ�Ļ�ѧ����ʽ��
________________________________________________________________________��
��2�����������У����ڴ��������(����)
A���٢ڢ� B���ڢ�
B���ڢ�
C���٢ڢܢ� D��ȫ��
��3����������� �У��������ڸ����Ȼ����������________��
�У��������ڸ����Ȼ����������________��
��4������������١��ܣ�����Ҫ��ѧ�ɷ���������______________(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�п��ܴ���Br����CO32����SO32����Al3+��I����Mg2+��Na+��7�������еļ��֣���ȡ����Һ����ʵ�飬�õ���������
������Һ�еμ�������ˮ����Һ���ɫ��������ɫ����ð����
�������ó�ɫ��Һ�м�������BaCl2��Һ���������ɣ�
����������Һ�м����μӵ�����Һ����Һ������ɫ��
�ݴ˿����ƶϣ�����Һ�п϶������ڵ��������ǣ�������
| �� | A�� | Al3+��Mg2+��I����SO32�� | B�� | Mg2+��Na+��CO32����I�� |
| �� | C�� | Al3+��Na+��SO32����I�� | D�� | Al3+��CO32����Br����SO32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�� 1L K2SO4��CuSO4�Ļ����Һ�У�c��SO42����=2mol•L��1����ʯī���缫������Һ����ͨ��һ��ʱ������ȫ�����������ռ���22.4L���壨��״������ԭ��Һ��c��K+��Ϊ��������
| �� | A�� | 0.5 mol•L��1 | B�� | 1 mol•L��1 | C�� | 1.5 mol•L��1 | D�� | 2 mol•L��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij����M�����ȵ��ʸߡ������µ��Ե�Ժá������²���ǿ�ȴ������������ܣ�����⣬M��ֻ�������ֶ�����Ԫ�أ���ȡ82gM����������NaOH��Һ��ǡ�÷�Ӧ���õ���ɫ��ҺA��44.8L����B���������Ϊ��״���£�����������ʹ��ɫʯ����ֽ����������Ӧ�����Һ����μ������ᣬ�ɹ۲쵽��Һ�ȱ���Ǻ����壮
����B������ת����ϵ��BCD EE��һ��ǿ�ᣮ��c��D�Ļ�����ܽ��ڽӽ���ȵ�ˮ�У����ɵõ�һ������F��ˮ��Һ����ش��������⣺
EE��һ��ǿ�ᣮ��c��D�Ļ�����ܽ��ڽӽ���ȵ�ˮ�У����ɵõ�һ������F��ˮ��Һ����ش��������⣺
��1������M�Ļ�ѧʽΪ�����������������壨����ӡ��������ӡ�����ԭ�ӡ��ȣ���
��2����ɫ��ҺA�ʼ��ԣ���ԭ���������������ӷ���ʽ��ʾ����
��3������F��һ�ֱȴ���������ǿ�����ᣬ�ܲ��ȶ���ͨ�����������ֽ⣮Ҫ�Ƶ�F��Һ���������䶳��������Ũ��Һ�м����ͨ��ij�����ʣ��������ʲ��ʺ�ʹ�õ�������������ţ���
a������ b��������̼ c��ϡ���� d����������
��4����ҵ���Է�ˮ��������NO��2���������۳�ȥ����֪�˷�Ӧ��ϵ�м�B���壮д��������Ӧ�����ӷ���ʽ�����������õ�ⷨ����ˮ��NO��2ת��ΪN2��ȥ��N2������������������������������ɣ��缫��ӦΪ������
��5���ַ���һ�ֻ��Ժ�ǿ�Ļ�����G�������ΪNH5��G��ˮ�ܲ����������壬����һ������ΪB��������G�ĵ���ʽΪ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ��������˵����ȷ���ǣ�������
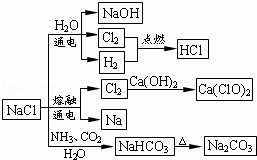
| �� | A�� | ʯ������Cl2�ķ�Ӧ��Cl2���������������ǻ�ԭ�� |
| �� | B�� | 25�棬NaHCO3��ˮ�е��ܽ�ȱ�Na2CO3�Ĵ� |
| �� | C�� | �����¸���Cl2���ø�ƿ���ˣ�����Cl2��������Ӧ |
| �� | D�� | ͼ����ʾת����Ӧ����������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ǵ����к����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���ã����ٵ���������ŷ��ǻ�����������Ҫ����֮һ����ش����е����仯�����������⣺
��1���ݱ������������ѧ�һ���˼����о���ֵ��N4������ӽṹ������ӵ���������ṹ���ƣ���֪����1mol N��N������167kJ����������1mol N��N���ų�942kJ��������д��N4����ת��ΪN2��Ӧ���Ȼ�ѧ����ʽ����N4��g��=2N2��g������H=��882kJ/mol����
��2���ݱ�����NH3��ֱ����������ȼ�ϵ�أ�д���õ�صĸ�����Ӧʽ����2NH3+6OH����6e��=N2+6H2O����
��3����T1��ʱ����5mol N2O5����10L�̶��ݻ����ܱ������з������з�Ӧ��2N2O5��g��⇌4NO2��g��+O2��g������H��0����Ӧ��5����ʱ�����ʵ�Ũ�Ȳ��ٷ����仯�����NO2���������Ϊ50%��
����÷�Ӧ��ƽ�ⳣ��K=��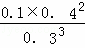 �������ִ���ʽ�Ӽ��ɣ�������ƽ����ϵ��O2���������Ϊ��12.5%����
�������ִ���ʽ�Ӽ��ɣ�������ƽ����ϵ��O2���������Ϊ��12.5%����
����O2��ʾ��0��5min�ڸ÷�Ӧ��ƽ�����ʦԣ�O2��=��0.02mol/��L•min������
�۽�����ƽ����ϵ���¶Ƚ���T2�棬�ܱ������ڼ�С���������С�AC����
A��ѹǿ B���ܶ� C����Ӧ���� D��N2O5��Ũ��
��4���ں��º��ݵ��ܱ������г���NO2����������ƽ�⣺2NO2��g��⇌N2O4��g����ƽ��ʱN2O4��NO2�����ʵ���֮��Ϊa�������������������£��ֱ��ٳ���NO2���ٳ���N2O4��ƽ�������ı仯��ȷ���ǡ�B����
A��������a��С
B��������a����
C������NO2����a��������N2O4����a����
D������NO2����a������N2O4����a����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йص������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
| �� | A�� | pH=3��һԪ���pH=11��һԪǿ��������Ϻ����Һ�У�c��OH����=c��H+�� |
| �� | B�� | ��0.1 mol•L��1Na2CO3��Һ�У�c��OH������c��H+��=c��HCO3����+2c��H2CO3�� |
| �� | C�� | ��֪�����ᣨHN3��������������������NaN3ˮ��Һ������Ũ�ȴ�С˳��Ϊ��c��Na+����c��OH¯����c��N3¯����c��H+�� |
| �� | D�� | 0.2 mol•L��1NaHCO3��Һ�м�������0.1 mol•L��1NaOH��Һ��c��CO32������c��HCO3������c��OH������c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�п��ܺ���Na+��NH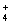 ��Ba2+��SO
��Ba2+��SO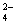 ��I����S2�����ֱ�ȡ��������pH�Ʋ��ԣ���Һ�������ԣ��ڼ���ˮ�͵�������������Ϊȷ������Һ����ɣ���������������
��I����S2�����ֱ�ȡ��������pH�Ʋ��ԣ���Һ�������ԣ��ڼ���ˮ�͵�������������Ϊȷ������Һ����ɣ���������������
A�� Na+ B��SO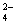 C�� Ba2+ D��NH
C�� Ba2+ D��NH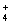
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com