
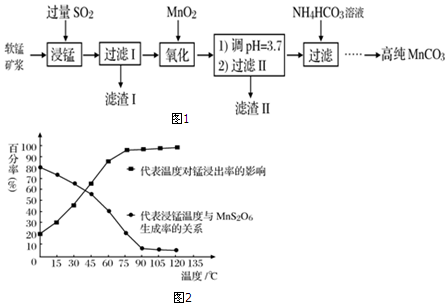
分析 软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3):由流程可知软锰矿形成矿浆,通入足量的SO2,发生反应,MnO2+SO2=MnSO4,Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+,加入二氧化锰氧化亚铁离子,反应为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,调节pH,沉淀铁离子,过滤,滤渣II为氢氧化铁,向滤液中加入碳酸氢铵溶液,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,通过洗涤、烘干得到MnCO3晶体,据此分析解答.
解答 解:(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经过氧化铁与酸反应生成铁离子,铁离子与二氧化硫反应实现的:Fe2O3+6H+=2Fe3++3H2O、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)软锰矿形成矿浆,通入足量的SO2,MnO2、Fe2O3与SO2反应生成Mn2+、Fe2+,SiO2不反应,过滤,滤渣I为,滤液含有Mn2+、Fe2+;
故答案为:Mn2+、Fe2+;
(3)MnO2与SO2反应的化学方程式为MnO2+SO2=MnSO4;
故答案为:MnO2+SO2=MnSO4;
(4)由图可知,90℃时,MnS2O6的生成率低,锰浸出率高,温度再高,变化不大,则“浸锰”的适宜温度是90℃;NH4HCO3受热易分解,温度不宜太高,防止NH4HCO3受热分解,提高原料利用率;
故答案为:90℃;防止NH4HCO3受热分解,提高原料利用率;
(5)Mn2+的滤液中加入NH4HCO3溶液后,发生彻底的双水解,生成MnCO3沉淀和二氧化碳,反应为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(6)生成的MnCO3沉淀需经充分洗涤,若未洗涤干净,洗涤液中含有硫酸根离子,故检验洗涤液中是否含有硫酸根即可,方法为:取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净;
故答案为:取1-2mL最后一次洗液于试管,滴加盐酸酸化BaCl2溶液,若无白沉淀产生,则洗涤干净.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、离子的检验等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 参加反应的酸和碱的物质的量相等 | |
| B. | 参加反应的酸中的H+总量和碱中的OH-总量相等 | |
| C. | 反应后混合液的pH=7 | |
| D. | 不能用适当的酸碱指示剂来判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
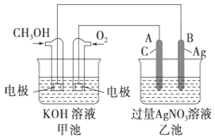 如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
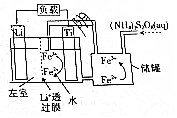
| A. | 左室电解质溶液为含Li+的水溶液 | |
| B. | 放电时,储罐中发生的离子反应为2Fe3++2SO42-═S2O82-+2Fe2+ | |
| C. | 充电时,钛极与外电源的负极相连 | |
| D. | 充电时发生的反应为Li++Fe2+$\frac{\underline{\;电解\;}}{\;}$Li+Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
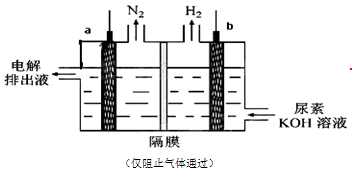
| A. | 为增强导电性,可用金属铜作阳极 | |
| B. | 电解过程中阴、阳极产生的气体物质的量之比为3:1 | |
| C. | 阴极的电极反应式为:2H2O+2e-═H2↑+2OH- | |
| D. | 阳极的电极反应式为:CO(NH2)2-6e-+8 OH-═CO32-+N2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Fe与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,2.24LCCl4的分子总数为0.1NA | |
| C. | 常温常压下,14g丙烯与环丙烷的混合气体,含碳原子总数为NA | |
| D. | 0.1mol/L CH3COONa溶液中含有的CH3COOH和CH3COO-总数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中9.6克硫粉与11.2克铁粉混合加热生成硫化亚铁17.6克时放出19.12 kJ热量,则Fe(S)+S(S)=FeS(S)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸和0.1mol/L的氢氧化钠溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则可知C的燃烧热△H=-110.5 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com