
25 ℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+) = 0.1 mol/L的混合溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如图所示。下列有关离子浓度关系叙述 一定正确的是( )
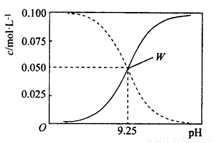
A.W点表示的溶液中c(NH4+)+c(H+)=c(OH-)
B.pH= 10.5的溶液中:c(Cl-)+c(OH-)+c(NH3 • H2O)<0.1 mol/L
C.pH= 9.5的溶液中:c(NH3 • H2O)>c(NH4+)>c(OH-)>c(H+)
D.向W点所表示的1L溶液中加人0.05 mol NaOH固体(忽略溶液体积变化):c(Cl-)>c(Na+ )>c(OH- )>c(NH4+)>c(H+)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届广东省七校联合体高三上学期第二次联考化学试卷(解析版) 题型:实验题
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒。某兴趣小组进行下面实验探究,查阅资料知道:
①HNO2为弱酸,
②2NO+Na2O2=2NaNO2,
③2NO2+Na2O2=2NaNO3
④酸性KMnO4溶液可将NO和NO2-均氧化为NO3-,MnO4-还原成Mn2+。
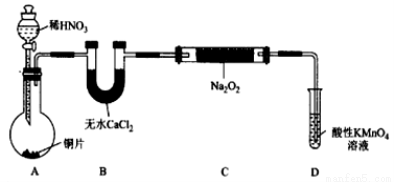
NaNO2的制备方法可有如下2种方法(夹持装置和加热装置已略,气密性已检验):
制备装置1:
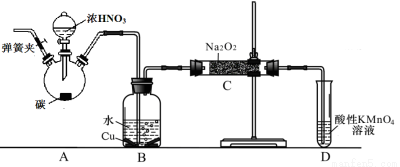
制备装置2:
(1)在制备装置1中:
① 如果没有B装置,C中发生的副反应有 ;
② 甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质;于是在A装置与B装置间增加了 装置,改进后提高了NaNO2的纯度;
③ D装置发生反应的离子方程式为 。
(2)在制备装置2中:
① B装置的作用是 ;
② 写出装置A烧瓶中发生反应的化学方程式并用单线桥标出电子的转移 ;
③ 为避免B中逸出的气体中混有的杂质气体与Na2O2反应,应在B、C装置间增加一个装置,则该装置中盛放的药品名称为 ;
④ 实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸钠溶液pH>1
c.0.1mol/L亚硝酸钠溶液中存在:c(Na+)+c(H+)=c(NO2-)+c(OH-)
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2-)>c(Na+)>c(OH-)>c(H+)
⑤ 试设计实验检验装置C中NaNO2的存在(写出操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源:2017届湖北省高三11月阶段测化学卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管 (LED).目前市售LED品片,材质基本以GaAs (砷化镓)、AlGaInP (磷化铝镓铟)、lnGaN (氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图。
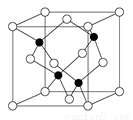
试回答:
(1)镓的基态原子的电子排布式是 。
(2)砷化镓晶胞中所包含的砷原子 (白色球)个数为 ,与同一个镓原子相连的砷原子成的空间构型为 。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是 . (用氢化物分子式表示)
(4)砷化镓可由 (CH3)3Ga和AsH3在700℃时制得. (CH3)3Ga中镓原子的杂化方式为 。
(5)下列说法正确的是 (填字母).
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
(6)若GaAs相对分子质量用M表示,阿伏伽德罗常数用NA表示Ga-As之间紧邻核间距用acm 表示,则砷化镓晶体密度近似为 。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上周考五化学试卷(解析版) 题型:选择题
剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
元索 | 相关信息 |
T | T元素可形成自然界硬度最大的单质 |
W | W与T同周期,核外有一个未成对电子 |
X | X原子的第一离能至第四电离能分别I1="578" kJ/mol; I2=" l817" kJ/mol;I3="2745" kJ/mol;I4=11575kJ/mol |
Y | 常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
Z | Z的一种同位素的质量数为63,中子数为34 |
(1) TY2是一种常用的溶剂,是__________(填“极性分子”或“非极性分子”),分子中存在________个σ键。
(2)W的最简单氢化物容易液化,理由是__________,.放热419 kJ,该反应的热化学方程式为 __________。
(3)基态Y原子中,电子占据的最高能层符号为__________,该能层具有的原子轨道数为_____________、电子数为_________。Y、氧、W元素的第一电离能由大到小的顺序为_________(用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为___________cm;ZYO4常作电镀液,其中ZYO42-的空间构型是__________,其中Y原子的杂化轨道类型是___________。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z +HCl+O2=ZC1+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是
A.O2是氧化剂
B.HO2是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上五调考试化学卷(解析版) 题型:选择题
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对从地表渗出的、当地人称为“石脂”或“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松果不及也,此物必大行于世”的描述, 关于上文的下列说法中正确的是 ( )
A.“洧水”的主要成分是油脂 B.“洧水”的主要成分是煤油
C.“洧水”的主要成分是石油 D.其烟的主要成分是石墨
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一月考二化学卷(解析版) 题型:选择题
已知在热的碱性溶液中, NaClO 发生反应: 3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A. NaCl、 NaClO B. NaCl、 NaClO3 C. NaClO、 NaClO3 D. NaClO3、 NaClO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:填空题
氧族元素包括氧、硫、硒、碲、钋。
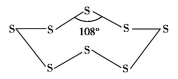
(1)单质硫的同素异形体很多,最常见的是斜方晶硫和单斜晶硫,经过测定,这两种硫的单质都是由S8构成的。S8分子的构型如图所示。S—S键的键角为108°,8个S原子形成两层,每层4个S原子。S8分子中S原子通过 杂化与其他原子成键,斜方晶硫和单斜晶硫中S8分子之间靠 结合在一起。
(2)氧及与其同周期的碳 、氮、氟四种原子的第一电离能由大到小的顺序是____________。
、氮、氟四种原子的第一电离能由大到小的顺序是____________。
(3) 用元素原子电负性的理论判断,H2O中的O—H键的键角 (填“>”、“=”或“<”)H2S中的S—H键的键角。
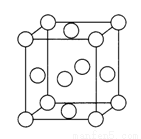
(4)硒是人体生命活动不可缺少的微量元素,适量的硒能够增强人体免疫力,延缓衰老,清除人体内的有害物质。如图是硒(Se)化锶(Sr)的晶胞模型,据此可知,每个硒化锶晶胞中含有的硒离子为___________个,其化学式为 。

查看答案和解析>>
科目:高中化学 来源:2017届西藏拉萨中学高三上期末理综化学卷(解析版) 题型:选择题
烃A分子式为C4H10,分子结构中含有一个次甲基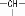 ,则此物质A的二溴代物的
,则此物质A的二溴代物的 种数为( )
种数为( )
A.5种 B.4种 C.3种 D、以上都不对
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com