
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y的摩尔质量相同,Y为淡黄色固体,N常温下是液体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )

A. 相对分子质量M>N,沸点M>N
B. 原子半径:D>B>C>A
C. Z 为 NaOH
D. M中含有非极性键
【答案】C
【解析】
短周期元素A、B、C、D的原子序数依次增大,X、Y、N分别是由以上四种元素中的两种组成的化合物,Y为淡黄色固体,可知Y为Na2O2;Z是由以上三种元素组成的化合物,则Z为NaOH;N常温下是液体,N为H2O,若X与Y摩尔质量相同,可知X为Na2S,M为H2S,结合原子序数及B和D同主族可知,A为H,B为O,C为Na,D为S,以此来解答。
A.N为H2O,M为H2S,相对分子质量M>N,水分子间含氢键,则沸点为N>M,故A错误;
B.一般电子层越多的原子,其原子半径越大,具有相同电子排布时,原子序数大的原子半径小,则原子半径:C>D>B>A,故B错误;
C.由上述分析可知,Z为NaOH,故C正确;
D.M为H2S,M中只含有极性键,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】三个装有CH4和Cl2 混合气体的集气瓶,用玻璃片盖好瓶口后,分别作如下处理,各有怎样的现象发生?
(1)①置于黑暗中: _____________________;
②将点燃的镁条靠近集气瓶外壁: ________________________;
③放在有光线的房子里: __________________________________。
(2)CH4和Cl2发生的一系列反应都是___________(填反应类型)反应,请写出CH4和Cl2反应生成一氯甲烷的化学方程式: ________________________________。
(3)若要使0.5 mol CH4完全和Cl2发生取代反应,并生成相同物质的量的四种取代产物,则生成HCl的物质的量为_________。
A.2.5mol B.2mol C.1.25mol D.0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化。在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(1)解释2 min~3 min反应速率最大的原因______;反应速率最小的时间段是_____,原因为____。
(2)在4min~5 min时间段内,用盐酸的浓度变化表示的反应速率为____。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A. Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 反应A(g) ![]() 2B(g) ΔH,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则ΔH=-(Ea-Eb) kJ/mol
2B(g) ΔH,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则ΔH=-(Ea-Eb) kJ/mol
B. 某温度下,氯化钠在水中的溶解度是20 g,则该温度下的饱和氯化钠溶液溶质的质量分数为20%
C. 将0.2 mol/L 的CH3COOH 溶液与0.1 mol/L 的NaOH 溶液等体积混合后,溶液中有关粒子的浓度满足下列关系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
D. 将浓度为0.1 mol/L HF 溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:
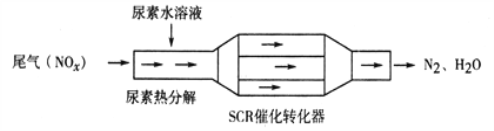
下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2![]() 2N2+12H2O
2N2+12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。
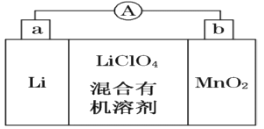
回答下列问题:
(1)外电路的电流方向是由______极流向______极。(填字母)
(2)电池正极反应式为 _____________________。
(3)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 _________________。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为__________。
(4)电解Na2CO3溶液,原理如图所示。
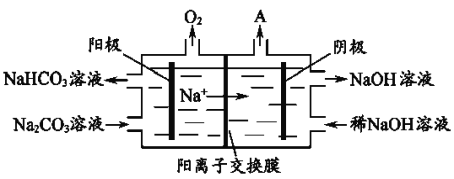
阳极的电极反应式为__________________,阴极产生的物质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)![]() 2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
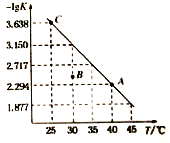
A. C点对应状态的平衡常数K(C)=10-3.638
B. 该反应的△H>0
C. NH3的体积分数不变时,该反应一定达到平衡状态
D. 30 ℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名![]() ,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
,tián),TS的原子核外最外层电子数是7.下列说法不正确的是( )
A. TS是第七周期第ⅦA族元素 B. TS的同位素原子具有相同的电子数
C. TS在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com